ENFERMEDAD DIARREICA AGUDA EN NIÑOS
ACUTE DIARRHEAL DISEASE IN CHILDREN
Ulises Reyes-Gómez 1, Katy Lizeth Reyes-Hernández 1, Luis Adolfo Santos-Calderón 1, Antonio Luévanos-Velázquez 2, Martín Guerrero-Becerra 2, Pedro Antonio Martínez-Arce 2, Jesús de-Lara-Huerta 3, Claudia Santamaría-Arza 4, Dr. Armando Quero Hernández1, Dr. Gerardo López Cruz1
1 Unidad de Investigación en Pediatría, Instituto San Rafael San Luis Potosí. México.
2 Servicio de Infectología Pediátrica, Antiguo Hospital Civil, Guadalajara, Jalisco. México.
3 Departamento de Infectología Pediátrica, Hospital Infantil Universitario de Torreón Coahuila. México
4 Servicio de Pediatría, Médica Sur, México.
Correspondencia: Ulises Reyes Gómez. Correo electrónico: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
Recibido: 08 de junio de 2018.
Aceptado: 19 de diciembre de 2018.
RESUMEN
La enfermedad diarreica aguda (EDA) es un problema de salud pública en el mundo, pero sobre todo en los países en desarrollo como México. La Organización Mundial de la Salud (OMS) estima que esta enfermedad origina 1.5 millones de muertes de niños al año, relacionadas con agua contaminada y saneamiento inadecuado. México se encuentra en los primeros lugares a nivel mundial de mortalidad en menores de 5 años. Hasta un 70% de estas muertes pueden evitarse con una sola estrategia: la terapia de rehidratación oral (TRO). Esta estrategia, aunada a otras como la de atención primaria a la salud, la inmunización para rotavirus, alimentación con leche materna, educación sobre EDA, acceso oportuno y diagnóstico efectivo de los casos, abatirían aún más las cifras de mortalidad.
Palabras clave: Disentería; Niño; Inmunización; Fluidoterapia; Atención Primaria de Salud
ABSTRACT
The acute diarrheal disease is a public health problem worldwide, but especially in developing countries like Mexico. The World Health Organization (WHO) estimates that this causes 1.5 million child deaths a year related to unsafe water and inadequate sanitation. In Mexico, it occupies first place over all mortality in children under 5 years. About 70% of these deaths can be prevented with a single strategy: oral rehydration therapy, which together with other strategies such as primary health care, rotavirus immunization, breastfeeding, education of this pathology, timely access and effective diagnosis of cases, the mortality figures are decreased.
Key words: Dysenetery; Child; Immunization; Fluid Therapy; Primary Health Care
INTRODUCCIÓN
El rotavirus es el principal agente involucrado en casos de enfermedad diarreica aguda (EDA). Esta enfermedad se define como una disminución en la consistencia de las heces (blandas o líquidas) y/o aumento en la frecuencia de las evacuaciones, la aguda suele durar en promedio siete días y no más de catorce días (1). Según la Organización Mundial de la Salud (OMS) esta enfermedad cobra la vida de 1.5 millones de niños al año. Un 80 a 90% de estos casos están relacionados con las condiciones ambientales, en particular agua contaminada y saneamiento inadecuado, por lo que son más comunes en países en vías de desarrollo (2). La mortalidad por EDA, particularmente por rotavirus, en México ocupa uno de los primeros lugares entre las enfermedades infecciosas en los niños menores de 5 años, pero más aún en los menores de un año. Origina el 20,8% de las demandas de consulta externa en los hospitales del sector público, 10,0% de hospitalizaciones pediátricas y 3 100 muertes al año (3). El 70,0% de estas muertes pudieron haberse evitado con la terapia de rehidratación oral (TRO) y la vacunación. Éstas ocurren generalmente fuera del hospital, en las zonas pobres donde el acceso a la atención médica y la aplicación de vacunas es limitado. Generalmente los niños menores de 5 años presentan de dos a cuatro cuadros diarreicos por año, por tanto el riesgo de morir durante el mismo es latente.
En México, desde la década de los 80, el rotavirus se ha reconocido como el principal enteropatógeno en preescolares sin diarrea (30,0%), con diarrea (54,0%) y en los menores de dos años hospitalizados por EDA en porcentaje de un 10,0 % en promedio se incrementa a 28,0%. La probabilidad de infección por rotavirus se incrementa con la edad, mientras que la probabilidad de EDA y EDA grave disminuye con las infecciones subsecuentes y con la edad. Se ha estimado que en la era anterior a la vacunación contra el rotavirus, la incidencia de infección por rotavirus era de un episodio por lactante por año y la de diarrea vinculada con rotavirus de 0.3 episodios por lactante por año.
La presencia de casos esporádicos de EDA por rotavirus en el recién nacido adquiridos en la comunidad, nos obliga a considerar dos estrategias: la primera es la aplicación de la vacuna en edades más tempranas y la segunda tiene que ver con el conocimiento de que estos cuadros se comportan en forma por demás benigna (mortalidad 0%) si los neonatos son alimentados con leche materna (4). La infección es más frecuente en los meses fríos y secos y muestra ciclos anuales, bianuales y quinquenales. Los serotipos G1, G2, G3 y G4 y los genotipos P1A[8] o P1B[4] comprenden 88,0% de los aislamientos en el mundo; el serotipo G9 emergió a finales del decenio de 1990 y actualmente representa 4,0% de los aislamientos; G1P1A[8] es la cepa predominante en el mundo y en América del Norte. En México, habitualmente se aíslan los serotipos G1, G3, G2, G4 y G9, y P1 y P2, en este orden de frecuencia. Se ha corroborado que en México la infección por rotavirus ocurre a lo largo del año con mayor frecuencia en invierno en menores de 24 meses de edad, mientras la mortalidad infantil por diarrea se ve disminuida en verano, persisten picos de mortalidad por esta causa en invierno.
A nivel nacional, en los menores de un año, la reducción anual promedio en el número de defunciones se duplicó de 7,8% entre 2000 y 2005 a 15,7% entre 2006 y 2007. En los estados que iniciaron la vacunación contra el rotavirus en 2006, la reducción anual promedio del número de defunciones se aceleró de 5,7% anual entre 2000 y 2005 a 16,9% anual entre 2006 y 2007; en cambio, en los estados que no iniciaron la vacunación contra el rotavirus en 2006, la reducción anual promedio del número de defunciones sólo se aceleró de 10,1% anual entre 2000 y 2005 a 14,7% anual entre 2006 y 2007. En este grupo de edad, y en los estados con vacunación inicial contra el rotavirus, la reducción anual promedio de la mortalidad por cada 1 000 menores fue de 4,6% antes de la vacunación (entre 2000 y 2005), y se aceleró esta reducción a 15,8% entre 2006 y 2007; mientras que en las entidades sin vacunación contra el rotavirus, la reducción anual promedio de la mortalidad fue de 9,0% anual entre 2000 y 2005 y de 13.9% entre 2006 y 2007.
Esta revisión básica se solventará principalmente en EDA por rotavirus y se complementará con algunos conceptos básicos en otras etiologías, de estas no solo habrá de incluir a E. coli, sino también a E. Histolytica en EDA polimicrobiana relacionada esta sobre todo en lactantes que tienen ya contacto frecuente con el piso en el gateo, y en donde por su edad y su conocimiento de las cosas a través de la boca (fase oral) llevan en forma muy frecuente sus dedos y objetos a la boca, originándoles diarrea. Es por ello que una de las indicaciones precisas de la Puericultura sobre todo a las madres jóvenes y nobeles lo constituye el lavado frecuente de las manos de los pequeños con agua y jabón las veces necesarias, otro aspecto relacionado a chuparse frecuentemente las manos lo es el brote dentario que de igual forma los expone a mayor de riesgo de EDA si el bebé no babea y continuamente deglute la saliva contaminada principalmente con Enterobacterias y E. Histolityca. En edades mayores la exposición a mascotas (gatos, perros, pericos, reptiles y peces) conlleva también el mismo riesgo de EDA.
En el caso de rotavirus se han postulado fuera de los mecanismos clásicos de transmisión: fecal-oral (ano-mano-boca), la vía respiratoria. Otros agentes virales implicados en EDA son: Adenovirus, Astrovirus (agua y alimentos), Calicivirus (Norwalk, Sapporo) y Parvovirus aunque no es lo frecuente pero si habrá de tenerlos presentes en presentaciones clínicas muy similares a rotavirus y otros virus de reciente implicación.
Otros agentes bacterianos lo constituyen: Campylobacter, Salmonellas, Shigella, Staphylococcus Aureus, Clostridium perfringens, Bacillus cereus, Vibrio cholerea, Vibrio parahemolitico, Clostridium difficile, Clostridium Botulinum, Yersinia enterocolitica, Aeromonas, Plesiomonas. De todos ellos para fines prácticos se adquieren por alimentos contaminados, excepto Shigella y E. coli por vía fecal y oral. Y Salmonella, Colera, Yersinia, Aeromonas también por agua. Yersinia por animales domésticos. Protozoarios como: Giardia Lamblia, Cryptosporidium y Entamoeba Histolytica por agua contaminada y esta última por alimentos. Finalmente existen cuadros de EDA por helmintos: Ascaris L., enterobius V., Anisakis simple, Himenolepsis nana, Tenias por mecanismo fecal-oral y alimentos contaminados.
En la EDA existen causas no infecciosas, dentro de ellas podemos encontrar cambios de la osmolaridad o alteraciones de la flora intestinal ocasionadas por la dieta y/o medicaciones, sobre todo antibióticos, estos la pueden ocasionar por un mecanismo irritativo de la mucosa digestiva, ya que al tener una pobre absorción, se mantienen en la luz intestinal; ocurre con la eritromicina que actúa a nivel del colon y en menor grado, con otros macrólidos, al igual que con el ácido clavulánico asociado a amoxicilina (actúa en tracto digestivo proximal y distal), ceftriaxona produce diarrea hasta en uno de cada dos niños que la reciben, debido a la alteración de la flora intestinal que induce, de igual forma aunque menos frecuente ocurre con Ampicilina. La intolerancia a la lactosa es una entidad sumamente rara que tiene cierto componente hereditario y por tanto familiar. Esta ocurre más frecuentemente en adultos asociada en no poca ocasiones a colonización crónica por G. Lamblia.
También puede aparecer diarrea por C. Difficile inducida por antibióticos, en estos casos su suspensión suele ser suficiente como diagnóstico y terapéutica. Debido a la importancia que este germen induce diarrea nosocomial vale la pena resaltar algunos aspectos básicos: Este es un bacilo grampositivo anaerobio, que aunque se considera un agente endógeno, también puede presentar un carácter exógeno debido a su capacidad para producir esporas. Puede estar presente en tracto digestivo de forma asintomática, ya que la clínica depende de la producción de exotoxinas A o B; así, la existencia de una IgG especifica frente a toxina A por debajo de 3000 unidades ELISA, aumenta 50 veces el riesgo de padecer la enfermedad. Su espectro clínico va desde la colitis pseudomembranosa a diarreas leves, e incluso se ha demostrado la existencia de portadores asintomáticos. El principal factor de riesgo de la diarrea asociada a C. Difficile es la administración de tratamientos antibióticos, pero también existen otras causas, como tratamientos quimioterápicos, antiulcerosos, etc. que se asocian a incremento de su patogenicidad.
Finalmente el aislamiento de patógenos en niños con EDA se consigue entre el 50,0 y 84,0% de los episodios. El agente más frecuentemente aislado es el Rotavirus. Otros microorganismos que se aíslan con cierta frecuencia son: Escherichia coli enteropatógena (ECEP), Escherichia coli enterotoxigénica (ECET), Campylobacter jejuni, Shigella sp (S. sonnei y S. flexneri dan cuenta de más del 86,0% de todos los aislamientos de Shigella), y Salmonella sp.
Solo en 10,0 a 20,0% de los episodios de diarrea se identifica más de un patógeno. La interpretación de algunos de estos microorganismos, como agentes causales del episodio de diarrea en estudio, es incierta. Esto es particularmente válido en el caso de la ECEP. Para fines prácticos los coprocultivos solo tienen indicación en enfermedad diarreica crónica, ya que los aislamientos de muchos de estos patógenos van más allá de 72 horas tiempo en el cual ya no es del todo práctico. Por tanto siempre ante todo cuadro de EDA habrá de considerarse los factores de riesgo para los mismos, estos son: Ambientales (ej.: agua inadecuada o con contaminación fecal, falta de facilidades sanitarias, mala higiene personal y doméstica, inadecuada preparación y almacenamiento de alimentos, ignorancia o patrones culturales adversos con malas prácticas del destete y tardía búsqueda de atención médica) y del huésped (ej.: desnutrición, deficiencias inmunológicas, factores genéticos, ausencia de lactancia materna).
Otra causa de EDA en niños hospitalizados es la alimentación enteral hiperosmolar. Esto es más frecuente en niños en cuidados intensivos, quienes frecuentemente cursan con íleo paralítico que les imposibilita tolerar soluciones enterales, especialmente si son hiperosmolares o si se administran volúmenes elevados. La aparición de EDA de causa intrahospitalaria nos obliga a extremar las precauciones universales basadas principalmente en el lavado de manos en tiempo y forma o bien al uso de alcohol con gel, esto último está demostrado ser tan efectivo y práctico como el lavado de manos, aunque se ha postulado cierta toxicidad por sobreabuso.
PREVENCION DE LAS EDA
Vacunación
Se considera al Rotavirus junto con E. coli como los principales agentes infecciosos causales de gastroenteritis en nuestro medio, aunque en no pocas ocasiones los cuadros de EDA pueden ser mixtos. En otro contexto se han hecho intentos por contar con una vacuna específica para E. coli, la única vacuna disponible en este momento es la de Rotavirus.
El esquema actual de inmunizaciones contempla la aplicación de la vacuna de Rotavirus monovalente (VR) VR-1 (2 dosis) aplicada a los 2 y 4 meses y si es VR-5 pentavalente (3 dosis) a intervalos de 2 meses: a los 2, 4 y 6 meses. Están disponibles en dos presentaciones: monovalente (VR1) y pentavalente (VR5). La primera dosis se debe de administrar entre las 6 y 14 semanas y 6 días de edad. La edad máxima para esta primera dosis es de 14 semanas y 6 días. El intervalo mínimo entre las dosis de la vacuna es de 4 semanas. De tal forma que para los 8 meses 0 días de edad deben de haberse administrado todas las dosis de la vacuna (5,6).
La vacuna de rotarix (VR1) fue autorizada para ser incluida en la Cartilla Nacional de Vacunación en enero del 2005, ésta contiene el serotipo G1, virus que más circula en México; sin embargo, se han presentado casos en lactantes previamente inmunizados en tiempo y forma (7), por lo que se justificó el cambio a los serotipos de rotavirus humanos G1, G2, G3, G4 y genotipo P1 (8). Estas cepas causaron cerca del 90,0% de las enfermedades por rotavirus de 1996 a 1999 en los Estados Unidos y más del 88,0% de ellas en todo el mundo entre 1973 y 2003, la eficacia de esta ha sido probada. Las precauciones standard para una mayor efectividad de la misma es el cuidado detallado de la red de frío, dado que estas vacunas son termolábiles, por ello para garantizar su inmunogenicidad y eficacia protectora, dentro de los programas de inmunización este es un requisito indispensable. El elemento fundamental en esta cadena es el personal responsable de la vacuna, que debe conocer las características de cada preparado con la finalidad de evitar errores en su manipulación (8). Para esto, se debe comprobar diariamente la temperatura del refrigerador, (específicamente este biológico se puede mantener estable entre 0 y 8 grados centígrados (habitualmente entre 2 y 8 grados centígrados) durante 18 a 24 meses, disminuyendo lenta y continuamente su potencia), vigilar que el almacenamiento se realice de manera adecuada, supervisar la disponibilidad de vacunas, revisar periódicamente el espesor de la capa de hielo del congelador (no debe superar los 5 mm), controlar la fecha de caducidad de cada lote (eliminar las vacunas caducadas), finalmente comprobar la tarjeta de temperatura en el momento de recepción de las vacunas (9).
Un reporte de Villanueva y cols (10) de eventos temporalmente asociados a la vacunación (ETAV) en México sucedidos entre 2003-2007 documentó que la tasa de reactogenicidad más elevada correspondió a la vacuna de rotavirus con 64 eventos, que corresponden a una tasa de ataque de 8.2 ETAV por 100 000 dosis aplicadas. Estos se dieron más en SSA, IMSS y medicina privada.
La vacuna se implementó en México en 2005 aunque este análisis abarcó 2006-2007 en este lapso se aplicaron 780, 747 dosis. En algunos casos estos eventos son causados por la propia vacuna; en otros, son el resultado de algún error en la administración de estas y en la gran mayoría de los casos, no existe relación con ellas, constituyendo eventos coincidentes.
La efectividad de la vacuna en México fue de una contundencia tal que un reporte de Richardson et al (11) mostró un disminución significativa de los casos de gastroenteritis por rotavirus, así como una disminución de la mortalidad aunados a otras medidas de saneamiento básico y el uso de la terapia de hidratación oral, previamente la seguridad y eficacia de la vacuna fue demostrada por Ruíz Palacios et al en EDA severa por este agente (12)
En el pasado, los intentos iniciales para desarrollar vacunas contra rotavirus se basaron en el uso de cepas vivas atenuadas de rotavirus animales, con el fín de incapacitarlas para producir la enfermedad pero inducir inmunidad. El siguiente enfoque fue replicar cepas humanas y animales a fin de generar vacunas contra virus replicados en epítopes humanos. En 1998 en Estados Unidos se introdujo al mercado una vacuna que consistía en virus replicados de mono Rhesus-humano (idéntica al serotipo G3 humano) y tres cepas de rotavirus mono Rhesus-humano (serotipos G1, G2 Y G4). Se administraban 3 dosis por vía oral para inmunización activa de lactantes entre 6 y 30 semanas de edad. En julio de 1999 fue retirada del mercado al informarse su relación causal con intususcepción o invaginación intestinal en uno de cada 10 mil menores vacunados, este efecto secundario ocurría principalmente en la primera semana después de la administración de la primera dosis de la vacuna (13). Actualmente tanto la vacuna monovalente como pentavalente para Rotavirus, prácticamente no tienen esta posibilidad causal y solo coincidente, cuidando que estas se apliquen en los esquemas y en tiempos recomendados.
Lactancia materna
Las cifras de lactancia materna en México están por debajo de la media mundial, la falta de leche materna a los recién nacidos y lactantes los expone a mayores tasas de ataques de EDA por la falta de anticuerpos que la madre aporta a través de ella.
En México, la leche materna ya no es el alimento exclusivo en los primeros seis de la vida, principalmente en las zonas rurales. Entre 2006 y 2012, el índice de lactancia materna registró a nivel nacional una caída de 7.9 puntos porcentuales, al pasar de 22,3 % a 14,5 %, principalmente por la introducción temprana de fórmulas lácteas Pero en el medio rural, el porcentaje bajó de 36,9% a 18,5%, de acuerdo con datos de la Encuesta Nacional de Salud y Nutrición (ENSANUT). Además, las mujeres de las zonas urbanas redujeron considerablemente el tiempo en que amamantan a sus hijos: mientras que hace seis años el promedio era de 8.5 meses ahora es de 4.9 meses. La media nacional es de 10.4 meses (14).
Se estima que 1.4 millones de muertes infantiles podrían evitarse cada año si los bebés fueran amamantados exclusivamente como lo recomienda la OMS. Esta es la intervención con mayor evidencia de eficacia para reducir la mortalidad neonatal hasta en un 66,0 y 87,0%. Muchos de los beneficios que se han estudiado de la leche materna en los bebés son: mejora la supervivencia, incluida la muerte súbita del lactante, disminuye la incidencia de enfermedades diarreicas, otitis media aguda, infecciones severas del tracto respiratorio, asma, dermatitis atópica, obesidad, diabetes tipo 1 y 2, leucemia, enterocolitis necrotizante, además de fortalecer el vínculo madre e hijo. Y los beneficios en las madres son: menor incidencia de cáncer de mama y ovarios, agiliza la pérdida de peso en el postparto, hay menos incidencia de diabetes tipo 2, se evita la depresión postparto, además de que ayuda en la economía de la familia.
Lamentablemente, las estadísticas del tiempo de lactancia materna exclusiva muestran que: solo el 82,0% de las mujeres amamantaron a su bebé durante 1 mes, el 56,0% lo hizo por 4 meses y el 30,0% hasta los 6 meses. Estas cifras demuestran que las mujeres siguen sin comprender la importancia de amamantar a su bebé exclusivamente con su leche por lo menos hasta los 6 meses(15). Aun cuando los recién nacidos estén siendo alimentados exclusivamente con leche materna, la posibilidad de adquirir rotavirus en la comunidad existe; sin embargo, la evolución clínica y el pronóstico de los casos es 10 veces mejor (3).
Cuadro clínico
En la historia clínica de la diarrea es esencial indagar sobre: duración de la enfermedad; características de las evacuaciones: consistencia: sea líquida, semilíquida, presencia de otros elementos (mucosidades, sangre, alimentos no digeridos); frecuencia de evacuaciones durante las 24 horas previas; presencia y frecuencia de vómitos; fiebre, irritabilidad, decaimiento, sed; capacidad o no de recibir alimentos y líquidos; tipo y volumen de los alimentos recibidos; normalidad o no de la diuresis. Luego, al practicar el examen físico, es esencial evaluar el estado general del niño, su estado de conciencia, y muy especialmente, el grado de deshidratación (Ver cuadro 1) así como la presencia de manifestaciones que puedan impartir un carácter especial al cuadro: distensión abdominal marcada (medición de circunferencia abdominal), disminución de ruidos intestinales, edema, fiebre alta. Es importante pesar al niño, puesto que así podrá objetivarse si sufrió o no una pérdida de peso importante durante la diarrea. Este cálculo es factible sólo si se conoce el peso previo del niño, registrado unos pocos días antes. En todo caso, el peso al ingreso servirá para ser usado como registro de línea base y valorar sus cambios durante el curso de la enfermedad. Finalmente, dada la importancia que reviste la clínica.
Cuadro 1. Evaluación del estado de hidratación de un paciente con diarrea.
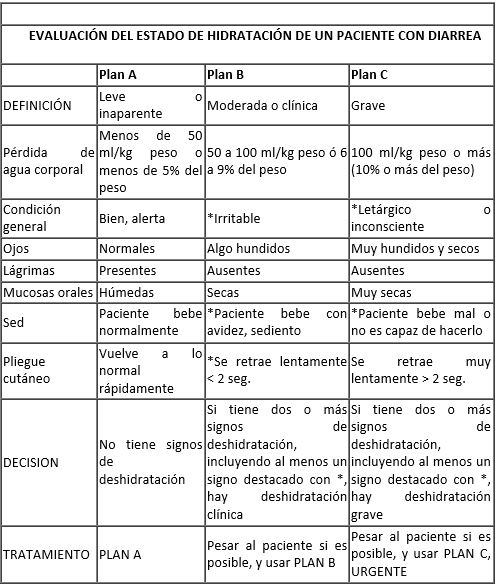
Adaptado de: "Readings on Diarrhoea: A Students' manual". WHO-Geneva, 2002
La sintomatología típica de la infección por rotavirus son: vómitos, seguido de diarrea, mucosa severa con restos de leche (más de 8 evacuaciones al día) pudiendo o no cursar con fiebre (37.8°C-39°C) siendo esta una enfermedad autolimitada con una duración promedio de aproximadamente 5 días (16). La gran mortalidad está asociada a la severa deshidratación que provoca la infección por lo que la recomendación principal en este padecimiento es rehidratar (17)
Los cuadros clínicos de rotavirus en el recién nacidos son diferentes en su sintomatología a la de los lactantes, en ellos predominan la distensión abdominal importante, diarrea, cólicos y vómitos. Generalmente se confunden con reflujo gastroesofágico o alergia a las proteínas de la leche de vaca. Por alguna razón poco conocida se presentan más en neonatos del grupo sanguíneo A positivo, presentan en un estudio de heces en el coprológico (que es el estudio ideal) grasas de ++ a ++++ y un ph de 5 o menor (18). No siendo necesario en todos los casos la confirmación de este por medio de un estudio en heces de rotaforesis, aglutinación en latex o ELISA, salvo si se cuenta con el recurso y se quiere ser más exacto el Rotaquick (aglutinación en latex) es la prueba ideal (19). Es importante considerar los anteriores datos clínicos mencionados en virtud que no es posible que no existan reportes clínicos de casos de rotavirus en el recién nacido, lo cual refleja que no se están realizando los diagnósticos como tal.
Terapia de Rehidratación Oral
La deshidratación es la complicación más frecuente en la EDA y es la causa principal de la mortalidad. El término deshidratación se emplea para designar el estado clínico consecutivo a la pérdida de agua y solutos, siendo la exploración física y el interrogatorio a los padres como esenciales para el diagnóstico, con ello el personal de salud puede clasificar el grado de deshidratación y formular un plan de tratamiento. Para la deshidratación leve y moderada se emplea la terapia de rehidratación oral (TRO), siendo el método de elección y la hidratación intravenosa para la deshidratación severa o choque hipovolémico (20).
A más de cinco décadas de los primeros reportes del uso de la TRO en México por Larracilla (21) en el Hospital Infantil de México, actualmente ésta constituye la piedra angular en el manejo de la EDA. Posteriormente Mota en el mismo lugar, logró un avance sin precedente con el uso de la TRO en México con resultados impresionantes para abatir la mortalidad, reduciendo 75,0% las hospitalizaciones, 80,0% los costos y 100% las complicaciones, decreciendo 73,0% las muertes por EDA en México de 26 610 en 1983 a 7215 en 1992 (22).
Fisiología. El intestino posee una notable capacidad de secretar y absorber el agua, experimentos en adultos muestran una absorción de aproximadamente 6500 ml por día de líquidos, incluídos los ingeridos y los de las secresiones intestinales, reducidos éstos a tan solo 100ml/día para la eliminación de heces. Esta absorción de agua es pasiva y depende del gradiente osmótico que es dirigido por el transporte de NA/H, el gradiente electroquímico y el transporte de sodio acoplado a solutos orgánicos (principalmente glucosa). En la EDA ocurren la interrupción de muchos de estos mecanismos, sin embargo el co-transporte facilitado de glucosa y de sodio es la base de la terapia de rehidratación oral (TRO).
En forma somera describiremos qué sucede durante la EDA en niños: en el intestino delgado se produce la absorción del agua y electrolitos por las vellosidades del epitelio y simultáneamente, la secreción de éstos por las criptas. Así, se genera un flujo bidireccional de agua y electrolitos entre el lumen intestinal y la circulación sanguínea. Normalmente la absorción es mayor que la secreción, por lo que el resultado neto es absorción, que alcanza a más del 90,0% de los fluidos que llegan al intestino delgado. Alrededor de 1 litro de fluido entra al intestino grueso, donde, por mecanismo de absorción, sólo se elimina entre 5 y 10 ml/kg/24 horas de agua por heces en lactantes sanos. Por lo tanto, si se produce cualquier cambio en el flujo bidireccional, es decir, si disminuye la absorción o aumenta la secreción, el volumen que llega al intestino grueso puede superar la capacidad de absorción de éste, con lo que se produce diarrea. El agua se absorbe por gradientes osmóticos que se crean cuando los solutos especialmente Sodio (Na+) son absorbidos en forma activa desde el lumen por la célula epitelial de la vellosidad.
Los mecanismos de absorción de Na+ son: a) absorción junto con Cl-, b) absorción directa, c) intercambio con protón, d) unido a la absorción de sustancias orgánicas, (glucosa, galactosa, aminoácidos). Después de su absorción, el Na+ es transportado activamente fuera de la célula epitelial (extrusión), por la bomba Na+ K+ ATPasa, que lo transfiere al líquido extracelular, aumentando la osmolaridad de éste y generando un flujo pasivo de agua y electrolitos desde el lumen intestinal a través de canales intercelulares. La secreción intestinal de agua y electrolitos ocurre en las criptas del epitelio, donde el NaCl es transportado desde el líquido extracelular al interior de la célula epitelial a través de la membrana basolateral. Luego el Na+ es devuelto al líquido extracelular, por la Na+ K+ ATPasa. Al mismo tiempo, se produce secreción de Cl- desde la superficie luminal de la célula de la cripta al lumen intestinal. Esto crea un gradiente osmótico, que genera flujo pasivo de agua y electrólitos desde el líquido extracelular al lumen intestinal a través de canales intercelulares.
En los mecanismos enterotoxigénicos de los patógenos, predomina el aumento de la secreción intestinal: secreción neta de agua y electrolitos. Sin embargo, en este mecanismo patogénico permanece intacta la bomba de sodio. De manera que, aunque está alterada la absorción de Na+, se trata de una acción reversible, mediante la adición de Glucosa o A-A que estimulan la absorción acoplada de Glucosa-Sodio. En esto se basa el uso de la TRO. Muchas de estas bacterias, además de su mecanismo E-I, producen enterotoxinas y se suma un mecanismo Enterotoxigénico. Los virus colonizan las células epiteliales de los enterocitos(vellosidades), penetran y se multiplican en el interior del enterocito, provocando su destrucción y posterior descamación hacia la luz intestinal. Bajo el entendido que cualquier cuadro de EDA no daña totalmente el número de enterocitos, dado que la superficie de absorción intestinal es comparada en tamaño similar a un campo de tenis y el número de enterocitos colonizados es mínima, por tanto, la mayor parte de la superficie de absorción está intacta.
En la revista Lancet en el año 1978 (23) fue publicado un artículo clásico que documentó las bases científicas en las que solventó el uso de la TRO. Éste fue considerado el avance más importante dentro de la medicina de los últimos tiempos por ser una terapia preventiva y curativa, de fácil aplicación y con un éxito impresionante, de tal forma que las epidemias de cólera en Bangladesh y otros países de la India y de África mostraron resultados importantes al disminuir las tasas de mortalidad que para esa época eran muy altas (24). Por la importancia que reviste este descubrimiento que ha salvado millones de vidas en el mundo, es merecido mencionar a Hirschhorm, Phillips, Sachar y otros para lograr el beneficio que actualmente tenemos con la TRO. "El estudio de la prueba de concepto fue que absorbería el fluido y disminuiría la cantidad de fluido diarreico que salía". "Las proporciones son cruciales para obtener la absorción óptima de agua necesitas la misma cantidad de glucosa y sodio".
La revista The Lancet describió la terapia de rehidratación oral como "potencialmente el más importante avance médico" del siglo XX y UNICEF añadió que ninguna otra innovación del siglo "ha tenido el potencial de impedir tantas muertes en un período tan corto de tiempo y a un costo tan bajo". Ahora, su efectividad es bien reconocida y utilizada en el todo el mundo, siendo aplicada en clínicas y hospitales, así como también en hogares por los padres de los niños, pero aun así dado lo simple de dicho forma de hidratar, aún existe poca credibilidad por algunos sectores del área médica lo que ha conllevado a continuar teniendo tasas de muertes que pudieron evitarse con su uso.
Desde principios de los 80s, la Organización Mundial de la Salud y el UNICEF han recomendado una fórmula única para la TRO a base de agua, electrólitos y glucosa (como transportador), para prevenir y tratar la deshidratación por diarrea de cualquier etiología y a cualquier edad (25). Este medicamento ha demostrado ser seguro y efectivo para reducir la mortalidad por EDA en niños. La fórmula contiene en g/L: cloruro de sodio 3.5, citrato trisódico deshidratado 2.9, cloruro de potasio 1.5 y glucosa 20.0. Al ser disuelta en un litro de agua proporciona en mmol/L: sodio 90, cloro 80, potasio 20, citrato 10 y glucosa 111, con pH entre 7 y 8, la osmolalidad total de la solución es de 311 mmol/L, semejante a la del plasma (26). Existen soluciones comerciales con osmolaridad superiores al plasma (407 a 419 mOsm/Kg) e incluso de 700 mOsm/Kg las cuales agravan la deshidratación y no son recomendables.
La fórmula se presenta concentrada en polvo y envasada en sobres para disolver en un litro de agua, con el nombre oficial en México de “Vida suero Oral”, está también disponible con diversos sabores que no modifican la composición ni la osmolaridad de la fórmula.
La efectividad de ésta depende de su transporte activo, a través de las membranas del borde de cepillo de los enterocitos, de iones de sodio acoplados con moléculas de glucosa, lo cual favorece la absorción pasiva de agua y otros electrólitos, la absorción conjugada de glucosa y sodio en el intestino delgado, se favorece en presencia de pH alcalino y se lleva a cabo en forma equimolar activa. La solución que contiene Sodio 90 mEq es también conocida como SOLUCION 90 y está indicada en deshidratación severa y tiene indicaciones en cualquier tipo de deshidratación iso, hipo, o hipernatrémica.
Durante los últimos años se han efectuado estudios para desarrollar un suero oral mejorado que siendo seguro y efectivo, también redujera el gasto fecal y la duración de la diarrea bajo dos líneas de investigación: modificar la cantidad o tipo de transportador utilizado para la absorción intestinal de sodio y agua y reducir la osmolaridad del suero oral para evitar los posibles efectos adversos de la hipertonicidad sobre la absorción de líquidos (27).
Se realizaron estudios en pacientes con cólera en forma experimental, sin embargo, sus ventajas no han sido suficiente para substituir la fórmula original, las que contienen maltodextrinas no son recomendadas en ningún caso, de las que contienen aminoácidos, la que contiene L-glutamina pudiera tener alguna aplicación para disminuir el gasto fecal (28) .
Existen fórmulas actuales de TRO que contienen menos cantidades de Na+ bajo el entendido que esto tiene menos riesgo de que ocurran casos de hipernatremia y que la tasa alta de diarrea sea menor, generalmente se emplean en niños eutróficos alimentados con fórmulas y que presenta EDA leve.
A pesar de este éxito con la rehidratación, una mayor comprensión de la fisiopatología de la diarrea infecciosa ha llevado a algunos investigadores a concluir que la composición de las sales de rehidratación oral inicial podría ser optimizados para ayudar a reducir el volumen de las heces y la duración de la diarrea, así como disminuir el potencial de riesgo de hipernatremia. En consecuencia, los trabajos se centraron en dos áreas de investigación: reducción de la osmolaridad y modificación del soluto orgánico de soporte (29, 30). Basándose en los resultados de un metanálisis (29) en el 2002, la OMS cambió la formulación de SRO a una de menor osmolaridad (245 mosmol / kg) con una menor concentración de glucosa (13,5 g / L [75 mmol / l]) y de sodio (75 meq / L) conservando una relación 1:1 molar de sodio y glucosa. Esta nueva fórmula sustituye a la original SRO, y es la única SRO utilizada a nivel mundial por la OMS.
El ABC de la EDA en el hogar consiste en tres reglas que siguen vigentes por su sencillez y lo práctico: alimentación continua, bebidas abundantes y consulta oportuna.
La alimentación continua consiste en no interrumpir la alimentación habitual, no introducir nuevos alimentos mientras persista la diarrea, solo evitar los muy concentrados o azucarados y los muy condimentados.
Bebidas: TRO ofrece media tasa cafetera (75mls) por cada evacuación si es menor de un año y una tasa cafetera (150mls) si es mayor de un año. Además: atole de arroz o de maíz, sopas de zanahoria, lenteja o papa, caldos o consomés desgrasados, jugos de frutas frescas, agua de coco verde, manzana, pera o guayaba cocida y yogurt.
Consulta oportuna. Donde se evalúa estado de hidratación, indicaciones de cómo preparar la TRO, datos de alarma para regresar pronto a consulta, es importante darles a conocer que La TRO no para la diarrea, pero ayuda a disminuir los vómitos y a mantener hidratado al paciente, con lo que mejorara su apetito y su estado general (31).
Los niños alimentados con leche materna deberán continuar así durante las fases del tratamiento de rehidratación y estabilización de la EDA. Aquellos alimentados con fórmula, (más del 80,0%), pueden manejarse con éxito después de la rehidratación, fórmulas lácteas no diluidas, incluyendo la introducción de dietas apropiadas a la edad en niños que están siendo destetados. La intolerancia a la lactosa generalmente es pasajera, y en pocas ocasiones requerirá formulas libres de lactosa o de soya en forma por demás transitoria, no más de dos semanas en la gran mayoría de los casos. Los esquemas de TRO están mencionados en las diferentes guías ampliamente conocidas pero es importante resaltar algunos aspectos.
Los motivos de fallecimiento de niños con EDA ocurren en algunas ocasiones porque el médico no evaluó adecuadamente el estado general de hidratación del niño, ni su estado nutricional (32), ni consideró algunos factores de riesgo como son: madre analfabeta o con poco interés o falta de conocimiento en ella para la detección de datos de alarma para acudir inmediatamente a su centro de salud más cercano.
Solo un 12,5% de las madres busca atención médica ante un cuadro de EDA en su hijo en las primeras 24 horas, 56,3% siguen un mal manejo alimentario, solo en 42,0% saben que la TRO puede prevenir la EDA; sin embargo, si se capacitan correctamente estas cifras mejoran al 100% y evitan hasta el 90,0% de los fallecimientos (33-36). Dar por entendido que el plan A no puede en cualquier momento pasar a plan B. En otros casos considerar el plan B como infalible, es decir, que no virara a plan C por tasa alta de diarrea (10 ml/kilo/hora) o por pobre tolerancia oral del niño, siendo de más riesgo los niños desnutridos.
Hasta un 5,5% de los pacientes que ya han sido hidratados regresan deshidratados a consulta durante el mismo episodio de EDA (37). En muchas comunidades de México la distancia de algunos hogares al centro de salud más cercano puede ser de horas, por tanto, una estrategia viable será que la madre con el niño pase la noche en el mismo, donde sea valorado y revalorado más tarde una vez terminado un esquema de hidratación. La clave como muchos tratamientos exitosos en pediatría consiste en la instrucción específica de la madre o de los cuidadores del niño, pues ellos una vez que notan mejoría en las condiciones del niño disminuyen o incluso suspenden la TRO, por tanto se requiere una mejor comprensión de su uso (38-40).
No está justificada la preparación de soluciones caseras, dada la disponibilidad de sobres para la TRO en todas las unidades médicas de todo el sector salud y en todo México. La intoxicación por sal puede ser de causa no accidental (maltrato infantil, síndrome de Munchausen por poderes) (41) o accidental por (sustitución de sal por ázucar, por ejemplo) administración de soluciones hipertónicas por vía enteral o intravenosa, ingestión de agua de mar, enemas hipertónicos o por mala utilización de sales de rehidratación oral. Esta última situación puede producirse por inadecuada dilución del contenido de sobres de sales de hidratación oral, exceso de aporte, indicación incorrecta o por preparación casera de sales de rehidratación oral. La consecuencia es un estado hipernatrémico severo, con predominio de manifestaciones y complicaciones neurológicas que plantea dificultades terapéuticas y conllevan mayor morbilidad y mortalidad (42).
CONCLUSIONES
La TRO es un medicamento considerado esencial por la Organización Mundial de la Salud, recomendada por la Academia Americana de Pediatría, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición (ESPGHN), La Sociedad Europea de Enfermedades Infecciosas Pediátricas (ESPID) y la Academia Mexicana de Pediatría (AMP), como tratamiento de primera línea en el tratamiento de niños con deshidratación leve a moderada causada por EDA e incluso enfermedad diarreica crónica. Esta terapia se emplea para tratar cualquier tipo de diarrea independientemente de su edad, el agente causal e incluso los niveles iniciales de sodio, con la ventaja de un menor costo y de utilizarse como terapia preventiva.
La determinación del tipo de deshidratación está dado por la cuantificación sérica del Na+. Se considera deshidratación isotónica (isonatrémica) con Na+ sérico entre 130 y 150 mEq/L. Deshidratación hipertónica (hipernatrémica) con Na+ sérico mayor de 150 mEq/L. Deshidratación hipotónica (hiponatrémica) con Na+ sérico menor a 130 mEq/L.
Habrá siempre en todos los casos, si se cuenta con el recurso, que determinar electrólitos séricos aunque para fines prácticos la gran mayoría de los cuadros de EDA son isonatrémicos y solo menos de un 5,0% son hipernatrémicos. En estos casos, las cargas rápidas y la hidratación total deberá de realizarse en forma más lenta, es decir, no considerar tres horas si no seis horas o más. Al menos en nuestro medio, el desequilibrio hidroelectrolítico más frecuente lo es la hipokalemia y no la hiponatremia como ocurría en el pasado. Por ello, creemos que la solución Hartman es la ideal, dado que contiene en su composición potasio. El fin último de esta hidratación rápida debe mostrar: una mejoría más rápida de la tolerancia oral, menor número de complicaciones y una recuperación de la homeostasis más efectiva.
Agradecimientos:
Al Dr. Felipe Mota Hernández, con quien hemos trabajado por más de 32 años, impulsando la rehidratación oral en México.
REFERENCIAS
- González SC, Bada MC, Rojas GR, Bernaola AG, Chávez BC. Guía práctica sobre el diagnóstico y tratamiento de la diarrea aguda infecciosa en pediatría 2011 Rev Gastroent Perú 2011; 31(3)
- Parashar UD, Gibson CJ, Breese JS, Glass RI. Rotavirus and severe childhood diarrhea Emerg Infect Dis 2003; 9: 565-72.
- Velásquez FR, García LH, Rodríguez E, Cervantes Y et al. Diarrhea morbity and mortality in Mexican children impact of rotavirus disease. Pediatr Infec Dis J. 2004; 23: 149-55.
- Castell RE, Reyes HD, Reyes GU, Reyes HU, Ávila CF, et al. Gastroenteritis por rotavirus en el recién nacido, reporte de doce casos adquiridos en la comunidad. Enf Infec Microbiol 2012; 32(3):108-13.
- Tregnaghi M, Falleiros L. Consenso 2014 de la Sociedad Latinoamericana de Infectología pediátrica. Esquema de vacunación recomendado para la población de 0 a 18 años de edad. Rev Enf Infec Ped 2014; 27(108): 439-47.
- American Academy of Pediatrics. Red Book; 2012 Report of the Committee on Infectious Pickering LK. Ed. 29th ed. Elk Grove Village IL.
- Reyes GU, Ramírez PB, Reyes HU, Hernández LI, Reyes HD, Martínez RA. Gastroenteritis por rotavirus en lactantes previamente inmunizados Rev Enf Infec Ped 2009; 23(89): 8-12.
- Ortega MP et al. Cadena de frío para la conservación de las vacunas en un centro de atención primaria en un área de Madrid. Mantenimiento y nivel de conocimientos. Rev Esp Salud Pub 2002; 76: 333-46.
- Picazo JJ. Guía de vacunaciones. Centro de Estudios de Ciencias de la Salud Madrid 2002.
- Villanueva DJ, Gómez AC, Esparza AM, Caro LJ, Herbas RI, López CV. Eventos temporalmente asociados a la vacunación: frecuencia, tendencia y distribución en México 2003-2007 Rev Enf Infec Ped 2010; 32(92): 124-34.
- Vesta R, Hernández PJ, Quintanar SM, Esparza AM, Johnson B, Gómez AC, et al. Effect of rotavirus vaccination on death from childhood diarrhea in México. N Engl J Med 2010; 362: 299-305.
- Ruíz-Palacios GM, Pérez SI, Velásquez FR. Safety and eficacy of an attenuated vaccine against severe rotavirus gastroenteritis. N Engl J Med 2006; 354: 11-22.
- Breese JS, Glass RI, Ivanoff B, Gentsch JR. Current status and future priorites for rotavirus vaccine development, evaluation and implementation in developing countries vaccine 1999; 17(18): 2207-22.
- Vega FL, Carbajal A, Velasco F. Galindo E, Romo G, Gamboa MD. El vómito con indicador clínico de la diarrea por rotavirus Bol Med Hosp Inf Mex. 1985; 42(3): 169-74.
- Mota HF, Gutiérrez CC, Villa CS, Calva MJ, Arias FC, Padilla NL, Guiscafré GH. Pronostico de la diarrea por rotavirus. Sal Pub Mex 2001; 43(6):524-8.
- Reyes GU, Pérez GI, López CG, Sánchez CN, Toledo RI. Valor del coprológico en la etiología de la diarrea aguda en menores de 5 años. Rev Mex Puer Ped 2004; 11(64): 102-8.
- Buesa J, Castillo J, Vila J. Diagnóstico microbiológico de las infecciones gastrointestinales SEIMC 2008; 2(30): 1-42.
- Botas SI, Ferreiro MA, Soria GB. Deshidratación en niños. Anales Médicos 2011; 56(3): 146-55.
- Larracilla AJ. A 50 años de iniciada la hidratación voluntaria en niños con diarrea Rev Mex Ped 2011; 78(2): 85-90.
- Mota HF. Nuevo modelo de manejo efectivo de diarrea en niños. Bol Med Hosp Inf Mex 1994; 51(5): 354-5.
- Water with sugar and salt. Lancet 1978; 2: 300-1.
- Disponibleen:http://www.bbc.co.uk/mundo/noticias/2014/08/140804_hombre_salvo_millones_vidas_hr
- Velásquez JL, Mota HF, Llausás ME, Puente TM, Kane QJ. Conceptos actuales sobe la fórmula para hidratación oral en niños con diarrea aguda. Bol Clin Hosp Inf Mex 1986; 43(2): 12636.
- Velásquez JL, Llausás ME, Mota HF. Ruíz BE. Características bioquímicas de las soluciones disponibles para hidratación oral en México. Bol Clin Hosp Inf Méx 1985; 42(7): 424-7.
- Hahn S, Kim Y, Garner P. Solución de rehidratación oral de osmolaridad reducida para el tratamiento de la deshidratación por diarrea aguda en niños (Revisión Cochrane). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd.).
- World Health Organization. Collaborating Centre for Drug Statistic Methodology. Anatomical Therapeutic Chemical (ATC) and Defined Daily Dose (DDD) Index 2009. Disponible en: http://www.whocc.no/atcddd/ 3
- World Health Organization 2007. WHO Essential Drug List Nº 15. Medicamentos esenciales. 15 th edición (Marzo 2007).
- Stanton B, Evans J, et al. Oral Rehydration Therapy. UpToDate. Last literature review version 2009; 17: 2.
- Mota HF. El ABC de las diarreas bebes CR.com.
- Corral TM, Martínez H, Flores HS, Ximena DM, Tumbul B, Levario CM. Creencias y conocimientos de un grupo de médicos sobre el manejo de la alimentación del niño con diarrea aguda. Salud Pública Mex 2002; 44(4): 303-14.
- Coronel CC. Problemas identificados en el manejo de la enfermedad diarreica aguda. Rev Cub Med Gen Integr 2000; 16(4): 340-5.
- Gutiérrez CC, Villa CS, Mota HF, Cabrales MR, Gómez UJ. Intervención educativa para el manejo efectivo de la diarrea en el hogar. Bol Clin Hosp Inf Mex 2004; 61(1): 19-28.
- Rafie ME, Hassouna AW, Hirschhorn N, Loza S, Miller P, Nagaty A. Effect of diarrhoeal disease control on infant and childhood mortality in Egypt. Report from the national control of diarreheal diseases proyect. Lancet 1990; 1: 334-8.
- Mota HF. Estrategias para la disminución de la morbimortalidad por diarreas agudas. Salud Publica Mex 1990; 32: 254-60.
- Guiscafré H, Gutierrez G, Reyes H, Martínez H, Pérez CR, Castro Y. Impact of an educational strategy for physicians to improve treatment practices of common diseases. Arch Med Res 1995; 26: 531-9.
- Martínez H, Saucedo G. Mothers perceptions about chilhood diarrhoea in rural México. J Diarrhoeal Dis Res 1991; 9: 235-43.
- Zodpey SP, Deshpande SG, Ughade SN, Kulkarni SW, Shrikhande SN, Hinge AV. A prediction model for moderate or severe dehydration in children with diarrhea. J Diarrhoeal Dis Res 1999; 17: 10-6.
- Bravo LD, Romero QG, Reyes MH, Tome SP, Guiscafré GH. Cumplimiento del manejo en el hogar a niños con diarrea aguda atendidos en un centro docente asistencial. Rev Mex IMSS 1995; 33(4): 391-5.
- Reyes GU, Loredo AA, Martínez ZM, Perea MA, Agustín VM. Formas raras de maltrato infantil: el síndrome de Munchausen por poder. Rev Mex Puer Ped 2002; 9(51): 90-4.
- Prego J, Forteza C. Intoxicación salina por sales de rehidratación de preparación casera. Arch Pediatr Urug 2001; 72(1): 29-33.
- Stanton B, Evans J, et al. Oral Rehydration Terapy Up to date Lost Literature review. 2009;17:2-14.
- Calvo MC, Milano MG. Hipotensión arterial. Shock hipovolémico en: Casado FJ, Serrano A. Urgencias y tratamiento del niño grave. 2ª edición Madrid: Ediciones Ergon; 2007.p.101-7.
- Word Health Organization. 2007 WHO essential drug list 15.
- Gutiérrez CC, Posadas TN, Mota HF. Hidratación mixta en lactantes con choque hipovolémico por diarrea. Bol Clin Hosp Inf Mex 1994; 51(6): 379-83.





