AISLAMIENTO Y RESISTENCIA A LOS ANTIMICROBIANOS DE STAPHYLOCOCCUS AUREUS EN PACIENTES DE UN HOSPITAL DE TLAXCALA
ISOLATION AND ANTIMICROBIAL RESISTANCE OF STAPHYLOCOCCUS AUREUS IN PATIENTS FROM A HOSPITAL IN TLAXCALA
Luis Adrián Sánchez-Huerta1, Israel Flores-Arenales2
1 Estudiante de la Licenciatura en Química Clínica. Facultad de Ciencias de la Salud, Universidad Autónoma de Tlaxcala. México
2 Hospital General de Tlaxcala. Secretaría de Salud de Tlaxcala. México
Correspondencia: Israel Flores Arenales. Correo electrónico: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
Recibido: 29 de noviembre de 2018
Aceptado: 19 de diciembre de 2018
RESUMEN
Se realizó una investigación documental retrospectiva de un año de duración de los aislamientos de Staphylococcus aureus obtenidos de pacientes atendidos en el Hospital General de Tlaxcala “Dr. Miguel Lima Ramírez” (HGT); para conocer la tasa de incidencia, los focos y el perfil de resistencia a los antimicrobianos de este microorganismo. Se documentaron 172 aislamientos (tasa de aislamiento 12,4%), la mayoría de ellos obtenidos a partir de muestras de vías respiratorias en niños de 1-10 años. La incidencia de casos aumentó de manera significativa durante el segundo periodo del estudio; los aislamientos de muestras respiratorias presentaron un comportamiento similar. El 85,5% de los aislamientos presentó resistencia hacia al menos un antibiótico y el 20,9% del total se clasificó como aislamientos multirresistentes (MDR). Solo el 14,5% de los aislamientos presentó un fenotipo salvaje según su prueba de susceptibilidad a los antimicrobianos (AST por sus siglas en inglés). La tasa de resistencia a meticilina (SARM) fue 6,4%, sin diferencias significativas entre periodos o grupos etarios. Las muestras obtenidas de vías respiratorias y de tracto vaginal fueron los principales focos de aislamiento de SARM. Adicionalmente, se identificaron aislamientos con fenotipo MSB, MLSB, MLSBi y VISA. No fue posible distinguir entre casos hospitalarios y asociados a la comunidad. Si bien se evidenció la presencia de Staphylococcus aureus y su capacidad para resistir el efecto inhibitorio de diversos antibióticos en el HGT, son necesarios más estudios al respecto en nuestra entidad.
Palabras clave: Staphylococcus aureus; Staphylococcus aureus Resistente a Meticilina; Farmacorresistencia Microbiana.
SUMMARY
A 1-year retrospective documentary investigation of Staphylococcus aureus isolates was performed in the General Hospital of Tlaxcala "Dr. Miguel Lima Ramírez" (HGT), to know the incidence rate, foci of infection and the profile of antimicrobial resistance. 172 isolates were documented (isolation rate: 12.4%), most of them were obtained from samples of respiratory tract in in children aged 1-10 years The incidence of cases increased significantly during the second period of our investigation. Respiratory isolates presented a similar tendency. 85.5% of the isolates presented resistance to at least one antibiotic and 20.9% were classified as multiresistant isolates (MDR), only 14.5% of the isolates showed a wild type phenotype according to their antimicrobials susceptibility test (AST). The meticilin resistance (MRSA) rate was 6.4%, without significant differences between periods or age groups. Respiratory and vaginal tract samples were the main focus of MRSA isolation. Additionally, isolates with MSB, MLSB, MLSBi and VISA phenotypes were identified. It was not possible to distinguish between hospital cases and those associated with the community. Although the evidence of the presence of Staphylococcus aureus and its ability to resist the inhibitory effect of various antibiotics in the HGT, it is necessary to carry out more studies about this in our state.
Key words: Staphylococcus aureus, Methicillin-Resistant Staphylococcus aureus; Drug Resistance, Microbial
INTRODUCCIÓN
Staphylococcus aureus es un microorganismo aislado frecuentemente en patología humana como agente etiológico de infecciones de piel y estructuras asociadas (PEA), infecciones endovasculares, neumonías, artritis sépticas, osteomielitis, infecciones asociadas a cuerpos extraños, sepsis(1), meningitis y neumonía necrotizante (2).
La presión que los antimicrobianos han ejercido sobre este patógeno ha propiciado que adquiera múltiples mecanismos de resistencia, llegando a la no susceptibilidad a vancomicina, considerada hasta hace poco como uno de los últimos recursos terapéuticos para este microorganismo (3).
En México no se tiene un registro del número de infecciones graves, del desenlace de las infecciones por SARM hospitalario o de adquisición en la comunidad, y en general existen pocos estudios sobre el tema. El objetivo de este trabajo fue determinar la frecuencia de aislamiento y el perfil de resistencia a los antimicrobianos de Staphylococcus aureus en uno de los hospitales con mayor cobertura sanitaria en el estado de Tlaxcala. Como objetivos secundarios se analizaron sus principales focos y su distribución epidemiológica entre los pacientes involucrados
MATERIALES Y MÉTODO
Se realizó un estudio documental retrospectivo de todos los aislamientos de Staphylococcus aureus causantes de procesos infecciosos en pacientes atendidos en el Hospital General de Tlaxcala “Dr. Miguel Lima Ramírez” durante el año 2017.
Se estimó la tasa de aislamiento a partir de la información disponible en la base de datos del sistema VITEK 2 (Biomeriux). Se valoró el foco de aislamiento y su distribución entre los pacientes involucrados considerando su edad y género. En caso de existir más de un aislamiento por paciente, se consideró solo al primero.
A partir de los resultados obtenidos en los ensayos de susceptibilidad a los antimicrobianos (AST) se estimó la tasa de resistencia a bencilpenicilina, oxacilina, clindamicina, eritromicina, levofloxacino, ciprofloxacino, moxifloxacino, gentamicina, Linezolid, nitrofurantoína, quinupristín/dalfopristín (Q/D), rifampicina, tetraciclina, tigerciclina, trimetoprim/sufametoxazol (T/S) y vancomicina. Se evaluaron los resultados obtenidos en las pruebas de resistencia inducible a la clindamicina y resistencia a cefoxitina. Se estructuraron patrones de resistencia (PR) y se identificaron fenotipos de interés clínico en Staphylococcus aureus.
Toda la información obtenida se analizó de forma global y posteriormente fue dividida en 4 periodos de 3 meses cada uno con el fin de evaluar el comportamiento de Staphylococcus aureus de manera longitudinal: Periodo 1 (P1): enero-marzo; Periodo 2 (P2): abril-junio; Periodo 3 (P3) julio-septiembre; Periodo 4 (P4) octubre-diciembre. Para evaluar la interdependencia de las variables se utilizó un test X2 con un valor p < 0.05. Se calculó el valor del odds ratio utilizando un intervalo de confianza de 95%.
RESULTADOS
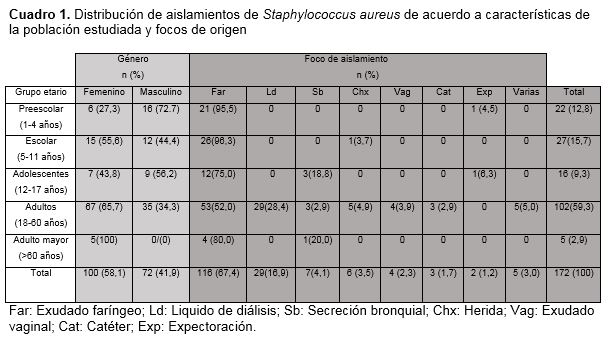
Tasa de aislamiento y distribución poblacional. Durante el periodo de estudio se contabilizaron 1386 aislamientos de microorganismos patógenos en el HGT. De los anteriores, 172 (12.4%) fueron identificados como Staphylococcus aureus por el sistema VITEK 2. Las muestras a partir de las cuales Staphylococcus aureus fue identificado, su distribución y tasa de incidencia para cada grupo etario se detallan en el Cuadro 1.
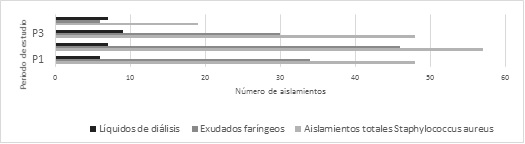
Al comparar el número de aislamientos totales de Staphylococcus aureus en los cuatro periodos de estudio, se detectó un descenso significativo en P4 respecto de P2 (X2=19.71; p<0.001; OR=3.26 [1.89-5.62]) y P1 (X2=10.49; p<0.001; OR=2.44 [1.04-4.25]). Las muestras faríngeas presentaron un comportamiento similar, con un descenso en su frecuencia en P4 respecto de P1 y P2 (X2=8.71; p<0.005; OR=5.26 [1.04-6.05] y X2=15.91; p<0.001; OR=9.6 [1.66-16.6] respectivamente). Por su parte, los aislamientos realizados a partir de Ld presentaron un aumento en su tasa de aislamiento en P4 respecto de P1 (X2=5.15; p<0.05; OR=0.24 [0.07-0.09]) y P2 (X2= 5.72; p<0.025; OR=0.24 [0.07-0.81]). La OR calculada para estos dos últimos no fue estadísticamente significativa. Los resultados se muestran en la Figura 1.
Figura 1. Distribución de aislamientos de Staphylococcus aureus en los 4 periodos de estudio y principales focos de aislamiento.
Resistencia a los antimicrobianos. El 14,5% de los aislamientos de Staphylococcus aureus mostró susceptibilidad a todos los antimicrobianos ensayados. El resto presentó resistencia a bencilpenicilina (83,1%), clindamicina (20,3%), eritromicina (14,5%), quinolonas (9,3%), gentamicina (8,7%), oxacilina (8,7%), tetraciclina (8,1%), T/S (8,1%) y vancomicina (2,9%). La resistencia a nitrofurantoína, rifampicina y tigeciclina fue menor al 1,0%. Ningún aislamiento presentó resistencia a linezolid o Q/D.
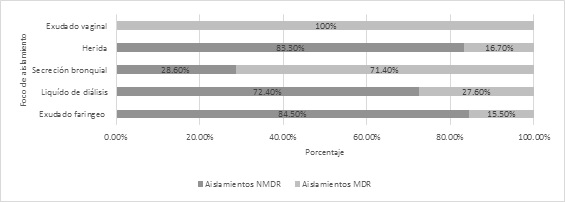
El 20,9 % de los aislamientos se clasificó como multirresistente (MDR) de acuerdo a los criterios descritos por Magiorakos et al (3). El 63,8% de estos fueron recuperados a partir de vías respiratorias (Far y Sb). La distribución de aislamientos MDR no mostró diferencias significativas entre grupos etarios (X2=3.117; p>0.05) o género (X2=0.12; p>0.05; OR=1.14 [0.54-2.39]). De modo similar, no se presentaron diferencias significativas en la incidencia de aislamientos MDR entre el inicio y el final del estudio (X2=0.049; p>0.05; OR=1.14 [0.36-3.55]) o entre periodos (Figura 2).
Figura 2. Aislamientos multirresistentes y no multirresistentes de Staphylococcus aureus de acuerdo a su foco de aislamiento.
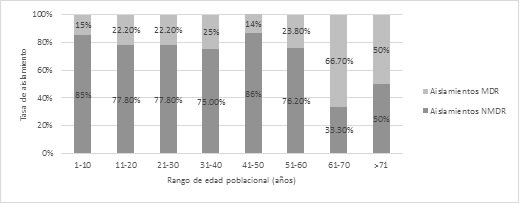
La distribución de aislamientos no multirresistentes (NMDR) y aislamientos MDR de acuerdo a la edad poblacional mostró una tendencia opuesta en cuanto a su tasa de aislamiento. Al aumentar el rango de edad poblacional los aislamientos MDR se presentaron con mayor frecuencia. Los aislamientos NMDR presentaron el efecto contrario (Figura 3).
Figura 3. Tasa de aislamiento de Staphylococcus aureus NMDR y MDR de acuerdo a la edad poblacional durante el periodo de estudio.
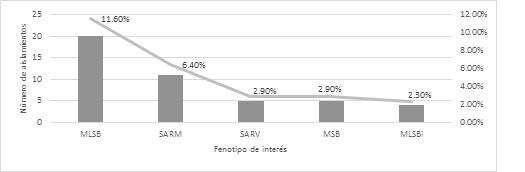
Caracterización del patrón de resistencia antimicrobiana de Staphylococcus aureus. Se caracterizaron 34 PR distintos (se excluyeron aquellos aislamientos con fenotipo salvaje). Resistencia exclusiva a bencilpenicilina (58,5%); resistencia a bencilpenicilina y tetraciclina (5,4%); resistencia a bencilpenicilina, clindamicina y eritromicina (4,08%). El resto de los PR mostraron una tasa menor al 3,0%. La Figura 4 muestra los fenotipos de interés clínico identificados.
Figura 4. Fenotipos de interés clínico identificados en Staphylococcus aureus durante el periodo de estudio.
SARM: Staphylococcus aureus resistente a meticilina; SARV: Staphylococcus aureus resistente a vancomicina; MLSB: Macrólidos, lincosamidas y estreptograminas B; MLSBi: Macrólidos, lincosamidas y estreptograminas B inducible; MSB: Macrólidos y estreptograminas B.
Staphylococcus aureus resistente a meticilina. Los aislamientos con fenotipo SARM se presentaron mayoritariamente en población adulta (81,8%), con un amplio predominio del género femenino (72,7%). Se aislaron principalmente (54,5%) a partir de muestras respiratorias (Far y Sb). El resto fue obtenido de Vag (36,4%) y Ld (9,1%). El 100% de las muestras vaginales incluidas en este estudio actuaron como reservorio de SARM.
La totalidad de los aislamientos SARM presentó resistencia a bencilpenicilina. Clindamicina y eritromicina presentaron ambos una tasa de resistencia de 72,0%. La resistencia a quinolonas se calculó en 54,55%. Trimetroprim/sulfametoxazol no presentó actividad ante el 27,3% de los aislamientos. Gentamicina y tetraciclina presentaron una tasa de resistencia de 18,2%. Durante el periodo de estudio solo se identificó un aislamiento resistente a rifampicina y otro a nitrofurantoína y tigeciclina, ambos tipificados como SARM. No se presentó resistencia a vancomicina o resistencia inducible a clindamicina en ningún aislado.
La totalidad de los aislamientos SARM se clasificaron MDR. No se observaron diferencias significativas en la frecuencia de aislamiento SARM entre la primera y segunda mitad de nuestro estudio (X2=1.12; p>0.05; 0R=0.51 [0.14-1.73]) (datos no mostrados).
Staphylococcus aureus resistente a vancomicina. Las muestras a partir de las cuales SARV fue recuperado correspondieron por frecuencia a: Far (40,0%), Chx (40,0%) y Ld (20,0%). El 60,0% de los casos se aisló de población adulta. Los dos casos restantes se recuperaron de escolares (20,0%) y adolescentes (20,0%). El género femenino representó el 80,0% de los aislamientos.
Staphylococcus aureus resistente a vancomicina no presentó sensibilidad a bencilpenicilina en ningún caso. La resistencia a clindamicina se situó en 40,0%; trimetoprim/sulfmetoxazol y oxacilina presentaron la misma tasa de resistencia (20,0%). Solo el 40,0% de los aislamientos se clasificó MDR. El 60,0% restante se consideró NMDR. Ningún SARM presentó resistencia a vancomicina. El 60,0% de los aislamientos SARV solo presentó resistencia acompañante a bencilpenicilina.
DISCUSIÓN
En el presente estudio, la tasa de aislamiento de Staphylococcus aureus fue 12,4%, una cifra menor respecto al 22,8% reportado por Montes et al (4) y al 30,0% por Hernández et al (5) en estudios similares. En México se ha reportado que entre un 33-43,0% de la población adulta se encuentra colonizada por Staphylococcus aureus (6), valor que al parecer se mantiene constante incluso en pacientes con VIH (7). De modo similar, se reporta que el 50,82% de pediátricos entre 1-11 años presentan colonización asintomática por este agente, un valor muy parecido al 53,6% observado en niños colombianos (8).
Una alta proporción de los aislamientos reportados (26,2%) se realizaron a partir de infantes de entre 1-10 años, lo que convierte a este grupo poblacional en un importante reservorio para esta bacteria. Estudios previos reportan que a mayor edad poblacional, el porcentaje de colonización por Staphylococcus aureus y SARM es menor (6,9).
Nuestros resultados colocan a los pacientes de entre 20-30 años como el segundo grupo poblacional con mayor número de aislamientos reportados. Sin embargo, si es posible observar un descenso en la frecuencia de los aislamientos al aumentar el rango de edad de la población estudiada. Aunque se esperarían resultados similares, este comportamiento no fue observado al analizar los casos SARM, los cuales, fueron obtenidos casi en su totalidad a partir de pacientes adultos. De modo similar, los aislamientos MDR se presentaron con mayor frecuencia en población adulta que en pediátrica.
Aunque en esta investigación el 58,1% de la población estudiada perteneció al género femenino y este predominó en todos los grupos etarios, no se ha establecido una relación directa entre género y el padecimiento de cuadros infecciosos por Staphylococcus aureus. Hamdan et al (6), reportan un porcentaje significativamente mayor de colonización nasal en hombres. No obstante, al analizar la colonización faríngea, estas diferencias se volvían imperceptibles. Estudios centrados en el análisis de procesos infecciosos por Staphylococcus aureus (5) y colonización en pacientes inmunocomprometidos (7) no reportan relación entre esta bacteria y el género de la población estudiada. El análisis aquí realizado no mostró interdependencia entre género y aislamientos MDR o SARM.
De igual manera, los resultados de este estudio sugieren que Staphylococcus aureus posee un marcado tropismo por causar procesos infecciosos en vías respiratorias, sobre todo en pacientes en extremos de la vida. Lo cual, toma especial importancia en el caso de SARM-CA por su capacidad para producir neumonía necrotizante (2). Los aislamientos obtenidos de FAR presentaron una mayor frecuencia durante el P2. A partir de este, se registró una disminución significativa que continuó hasta el final del estudio. Lo que sugiere una mayor incidencia de infecciones respiratorias bacterianas durante la primavera, tal como ya ha sido reportado previamente (10).
Investigaciones previas le atribuyen solo el 9,0% de los aislamientos de Staphylococcus aureus a muestras de vías respiratorias, colocando a los exudados de herida y ulcera como los principales focos de infección (11); focos que en nuestro estudio pertenecieron a la minoría. Togneri et al (1), reportan que los aislamientos respiratorios son superados en frecuencia por aquellos recuperados de sangre y PEA. Estudios similares, colocan a los aislamientos sanguíneos como los más recurrentes, seguidos de los obtenidos de muestras oftálmicas (12).
Aunque nuestra investigación no mostró a Staphylococcus aureus como agente etiológico de bacteremia, se le atribuyen el 7,3% del total de hemocultivos positivos en un hospital mexicano de tercer nivel (13).
Los Ld, se presentaron como la segunda muestra clínica con mayor frecuencia de aislamientos. Se sabe que Staphylococcus aureus es el agente etiológico de más del 50,0% de las infecciones relacionadas con catéter peritoneal (15). Aunque nuestros resultados no muestran a los Ld como el principal origen de SARM, Gómez et al., durante el año 2012 (16), reportaron un 29,6% de colonización por este agente en pacientes sometidos a procesos de diálisis.
Los aislamientos realizados a partir de Cat significaron solo el 1,7% del total. Sin embargo, Staphylococcus aureus, durante el periodo 2007-2010, causó más del 20,0% de las bacteremias asociadas a catéter registradas en el programa VINCat (14). Los estafilococos coagulasa negativos y Staphylococcus aureus son los agentes etiológicos más frecuentes en infecciones relacionadas con dispositivos intravasculares (14).
Bencilpenicilina se ubicó como el antimicrobiano con la mayor tasa de resistencia. La no susceptibilidad esta última suele relacionarse con la producción de betalactamasas del subgrupo 2a clase molecular A (17). Siendo este el probable mecanismo detectado con mayor frecuencia y sin resistencia accesoria en más de la mitad de los casos reportados. En el 5,44% de los aislamientos, la resistencia a bencilpenicilina se acompañó de resistencia a tetraciclina, lo que podría indicar la presencia de bombas de efflux codificadas por el gen tetK (18). La tasa de resistencia a tetraciclina fue 8,1%, una cifra menor al 15,5% reportado por Hamdan et al (6). Ya que los integrones que confieren resistencia a tetraciclina suelen portar genes de resistencia a otros antibióticos (18), en nuestra serie ningún PR mostró resistencia en solitario a tetraciclina.
La tasa de resistencia a quinolonas fue equivalente para los tres antibióticos incluidos en este grupo y nuestros resultados superan al 2,6% de resistencia a ciprofloxacino reportado por Montes et al (4). En nuestra serie, la resistencia a gentamicina fue mayor a la reportada por Montes et al (4) y Hamdan et al (6) (1,0% y 2,0% respectivamente). Esta no se presentó en solitario en ningún PR y en todos los casos se acompañó de resistencia a bencilpenicilina.
La tasa de resistencia a macrólidos y lincosamidas reportada por Handam et al (6) para Staphylococcus aureus durante 2010 fue 23,1% y 6,2% respectivamente. Nuestros resultados muestran menor resistencia a eritromicina y una tasa de resistencia a clindamicina de casi el triple comparada con el caso anterior. Se considera que el fenotipo inducible se presenta con mayor frecuencia que el constitutivo (19, 20). Sin embargo, en nuestro estudio solo el 20,0% de los aislamientos MLSB presentaron un fenotipo inducible.
Handam et al (6) y Borraz (21) reportan una tasa de resistencia a cotrimoxazol en Staphylococcus aureus menor al 2,0%. Nuestros resultados la estiman en 8,1%, un valor semejante a lo encontrado por Ponce de León et al (13) (10.3% durante 2007). En todos los casos se acompañó de resistencia a bencilpenicilina y clindamicina.
Se considera que la resistencia a vancomicina en Latinoamérica es cercana al 0% (22). Sin embargo, se conocen reportes acerca de infección por SARV, desde el año 2002 en Estados Unidos de Norteamérica (23). El 40% de los aislamientos SARV se recuperó a partir de FAR, dato coincidente al 39,1% reportado para vías respiratorias por Moise et al. en 2004(24). De modo similar a lo reportado por Mandal et al (25), ningún SARV presentó resistencia a ciprofloxacino y el 60,0% se mostró no susceptible a lincosamidas. Aunque en nuestro estudio ningún aislamiento SARV fue tipificado como SARM por el sistema VITEK 2, la mayoría de los reportes publicados relacionan la disminución en la sensibilidad a glucopéptidos con cepas mecA positivas (23, 24, 25, 26, 27)
En México durante el periodo 2004-2010 se reportó una tasa promedio de aislamientos SARM de 42,2% (con una considerable variación año con año) (22). De manera similar, el 8,6% de la población mexicana cursa colonización por SARM en vías respiratorias altas (6). En nuestra investigación, de forma análoga a lo observado en los aislamientos MDR, el 81,8% de los SARM se recuperó de población adulta. Al parecer, aunque los pacientes pediátricos presentan un mayor porcentaje de colonización (6, 9), los cuadros infecciosos por SARM ocurren con mayor frecuencia en pacientes adultos. El trabajo de Echániz et al (28) muestra una tendencia epidemiológica similar a lo aquí descrito.
Los exudados vaginales representaron el segundo origen más frecuente de SARM. De manera global, el 100% de los aislamientos vaginales obtenidos durante nuestro estudio fueron meticilino resistentes. Aunque Staphylococcus aureus es reconocido como agente etiológico de disbacteriosis vaginales (29,30) son escasas las referencias a SARM en el mismo ámbito.
Ningún aislamiento SARM obtenido durante nuestro periodo de estudio presentó resistencia a vancomicina. Este resultado concuerda con lo observado en aislamientos previamente realizados en México (6) y países de Latinoamérica (22). Aun así, la presunta sensibilidad a glucopéptidos debería confirmarse mediante métodos no semiautomatizados. Sobre todo al saber que el uso de vancomicina en infecciones por SARM acarrea más de un 70% de fallas en el tratamiento, aun cuando estos aislamientos presentan una CMI dentro del rango de susceptibilidad (24).
CONCLUSIONES
Staphylococcus aureus con fenotipo SARM, SARV, MLSB, MLSBi y MSB están presentes como agentes etiológicos de procesos infecciosos en pacientes atendidos en el Hospital General de Tlaxcala. Asimismo, pudo documentarse el como la tasa de aislamientos MDR y SARM es mayor en población adulta que en pediátrica.
El aislamiento de SARM a partir de exudados vaginales aquí mostrado es un evento poco documentado y que demuestra la capacidad adaptativa de este microorganismo. Esto hace necesario reconocer a SARM causante de vaginitis aeróbica y en general, a Staphylococcus aureus, como un agente presente en el estado de Tlaxcala, con una gran capacidad patógena y que debe ser tratado siguiendo los resultados del AST.
Aunque no mostraron niveles exageradamente elevados de resistencia a los antimicrobianos en Staphylococcus aureus, es importante hacer un uso racionalizado de estos fármacos, evitando en la medida de lo posible tratamientos empíricos y analizando de manera interpretada los resultados de cada antibiograma.
REFERENCIAS
- Togneri A, Podestá L, Pérez M, Santismo G. Estudio de las infecciones por Staphylococcus aureus en un hospital general de agudos (2002-2013). Revista Argentina de Microbiología 2016; 49(1): 24-31. Disponible en: http://dx.doi.org/10.1016/j.ram.2016.09.006
- Fernández S, Murzicato S, Sandoval O, Fernández L, Mollerach M. Community-acquired necrotizing pneumonia caused by methicillin-resistant Staphylococcus aureus ST30-SCCmecIVc-spat019-PVL positive in San Antonio de Areco, Argentina. Revista Argentina de Microbiología 2015; 47 (1):50-53.
- Magiorakos A, Srinvasan A, Carey R, Carmeli Y, Falagas M, Giske C, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Bacteriolog 2011;18: 268-281.
- Montes O, Milanés R, Álvarez A, Coronado S, Reyes N. Características moleculares y susceptibilidad a antibióticos de Cepas de Staphylococcus aureus Colonizantes de Pacientes con Patologías nasales Procedentes de Cartagena (Colombia), 2015: estudio observacional. Archivos de medicina 2015;15(2): 226-240.
- Hernández P, Quintero G, Mesa D, Molano L, Hurtado P. PREVALENCIA DE Staphylococcus epidermidis Y Staphylococcus aureus EN PACIENTES CON CONJUNTIVITIS. UNIVERSITAS SCIENTIARUM 2005;10(2): 47-54.
- Hamdan A, Sainz T, Bustos J. Characterization and Persistence of Staphylococcus aureus Strains isolated from the Anterior Nares and Throats of Healthy Carriers in a Mexican Community. JOURNAL OF CLINICAL MICROBIOLOGY 2010;48(5): 1701-1705.
- Velásquez LA, Sánchez DM, Hernández O, González A, Henao D, Pérez A, et al. Colonización por Staphylococcus aureus en una población de pacientes VIH positivos de la ciudad de Medellín: perfil de sensibilidad antimicrobiana y caracterización de la resistencia a meticilina. Publicación científica en ciencias biomédicas 2010; 32(1): 133-139.
- Rodríguez E, Ruiz A, Maritza L, García N, Jiménez J. Diseminación de cepas Staphylococcus aureus sensible a meticilina
(SASM) relacionadas genéticamente, pertenecientes al CC45, entre portadores nasales sanos de hogares infantiles de Medellín, Colombia. Enfermedades infecciosas y microbiología clínica 2015;34(3): 159-165. - Gorwitz RJD, Kruszon-Moran SK, McAllister G, McQuillan LK, McDougal GE, Fosheim BJ, et al. Changes in the prevalence of nasal colonization with Staphylococcus aureus in the United States, 2001–2004. J. Dis. 2008; 197:1226–1234.
- Bisno AL, Gerber MA, Gwaltney JM. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Clinical Infectious diseases 2002;35(3): 113-25.
- Rivero B, Flórez J, Méndez S. Diversidad de clones de Staphylococcus aureus resistentes a meticilina y emergencia de nuevos clones encontrados en comunidades de Tenerife, punto caliente de turismo en España. Trauma Fund MAPFRE 2011;23(3): 191-198.
- Velazco E, Nieves B, Araque M, Calderas Z. Epidemiología de infecciones nosocomiales por Staphylococcus aureus en una unidad de alto riesgo neonatal. Enfermedades infecciosas y microbiología clínica 2002; 20(7): 321-325.
- Ponce-de-León A, Camacho A, Macías A, Landín C, Villanueva C, Trinidad D. Epidemiology and clinical characteristics of Staphylococcus aureus bloodstream infections in a tertiary-care center in Mexico City: 2003-2007. Revista de investigación clínica 2010;62(6): 553-559.
- Ferrer C, Almirante B. Infecciones relacionadas con el uso de los catéteres vasculares. Enfermedades infecciosas y microbiología clínica 2013; 32(2): 115-124.
- Fariñas M, García J, Gutiérrez M. Infecciones asociadas a los catéteres utilizados para la hemodiálisis y la diálisis peritoneal. Enfermedades infecciosas y microbiología clínica 2008; 26(8): 518-526.
- Gómez M, Campos R, Pascua J, Marigliano N, Lancho J, Teno P. Manejo de la colonización por Staphylococcus aureus meticilin resistente en pacientes y profesionales de una unidad de hemodiálisis, en una situación de elevada endemia: ¿objetivo cero? Enfermedades infecciosas y microbiología clínica 2010; 30(3): 115-124.
- Morejón M. Betalactamasas de espectro extendido. Revista Cubana de Medicina 2013;52(4): 272-280.
- Vicente D, Pérez E. Tetraciclinas, sulfamidas y metronidazol. Enfermedades infecciosas y microbiología clínica 2009; 28(2): 122–130.
- Merino M, Cantos A, Torres M, Aznar J. Detección de resistencia inducible a clindamicina en aislados cutáneos de Staphylococcus spp. por métodos fenotípicos y genotípicos. Enfermedades infecciosas y microbiología clínica 2006;25(2): 77.
- Torres C, Cercenado E. Lectura interpretada del antibiograma de cocos gram positivos. Enfermedades infecciosas y microbiología clínica 2010; 28(8): 541-553.
- Borraz C. Epidemiología de la resistencia a Meticilina en cepas de Staphylococcus aureus aisladas en hospitales españoles. (Tesis doctoral). Universidad de Barcelona, Barcelona. 2006.
- Garza E, Dowzicky M. Changes in Staphylococcus aureus susceptibility across Latin America between 2004 and 2010. The Brazilian Journal of Infectious Diseases 2013;17(1): 13-19.
- Appelbaum P. Reduced glycopeptide susceptibility in methicillin-resistant Staphylococcus aureus (MRSA). International Journal of Antimicrobial Agents 2007; 30(1): 398-408.
- Moise P., Sakoulas G, Eliopoulos G, Schentag J, Forrest A, Moellering C. Accessory Gene Regulator Group II Polymorphism in Methicillin-Resistant Staphylococcus aureus Is Predictive of Failure of Vancomycin Therapy. Clinical Infectius Diseases 2004; 38: 1700-1705.
- Mandal S, Ghosh A, Bikas P. Dissemination of antibiotic resistance in methicillin-resistant Staphylococcus aureus and vancomycin resistant S aureus strains isolated from hospital effluents. American Journal of Infection Control 2015; 43: 87-88.
- Errecalde L, Ceriana P, Gagetti P, Erbín M, Duarte A, Rolón M, et al. Primer aislamiento en Argentina de Staphylococcus aureus resistente a la meticilina adquirido en la comunidad con sensibilidad intermedia a la vancomicina y no sensibilidad a la daptomicina. Revista Argentina de Microbiología 2013; 45(2): 99-103.
- Ortwine J, Werth B, Sakoulas G, Rybak M. Reduced glycopeptide and lipopeptide susceptibility in Staphylococcus aureus and the “seesaw effect”: Taking advantage of the backdoor left open? Drug Resistance Updates. 2013; 16: 73-79.
- Echániz G, Velázquez M, Aires M, Morfín R, Rodríguez E, Carnalla N. Molecular characterization of a dominant methicillin-resistant Staphylococcus aureus (MRSA) clone in a Mexican hospital (1999–2003). Clinical Microbiology and Infectious Diseases 2005; 12: 22-28.
- Donders G, Vereecken A, Bosmans E, Dekeersmaecker A, Salembier G, Spitz B. Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis. International Journal of Obstetrics and Gynaecology 2002; 109: 34-43.
- Herrero D, Domingo A. Vaginosis bacteriana. Enfermedades Infecciosas y Microbiología Clínica 2016; 34(3): 14-18.