FALLA ORGÁNICA MÚLTIPLE SECUNDARIA A VARICELA COMPLICADA POR STAPHYLOCOCCUS AUREUS ASOCIADA AL USO DE NIMESULIDA
MULTIPLE ORGAN FAILURE SECONDARY TO CHICKENPOX COMPLICATED BY STAPHYLOCOCCUS AUREUS ASSOCIATED WITH THE USE OF NIMESULIDE
Ernesto Garzón-Sánchez1, Katy Lizeth Reyes-Hernández2, Luis A. Santos-Calderón2, Gabriela A. Bautista-Aguilar3, Carmen Bautista-Aguilar3, Ulises Reyes-Gómez3,4, Martín Guerrero-Becerra5, Gerardo López-Cruz1, Alfonso Echeverría-Ramírez1, Claudia Santamaría-Arza4
1 Servicio de Pediatría, Hospital Civil “Dr. Aurelio Valdivieso”, Servicios de Salud de Oaxaca. México.
2 Unidad de investigación Pediátrica. Instituto San Rafael San Luis Potosí. México
3 Servicio de Pediatría. Clínica Diana de Especialidades. Oaxaca, México.
4 Academia Mexicana de Pediatría.
5 Servicio de Infectología Pediátrica. Antiguo Hospital Civil de Guadalajara. México.
Correspondencia: Ulises Reyes-Gómez. Correo electrónico: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
Recibido: 17 de marzo de 2018
Aceptado: 18 de abril de 2018.
RESUMEN
Introducción. La varicela es una enfermedad viral aparentemente benigna; sin embargo, cuando cursa con complicaciones, su morbilidad y mortalidad es elevada.
Caso clínico. Preescolar femenino de 3 años de edad, inmunocompetente, sin antecedente de inmunización para varicela, quien cursó con cuadro típico de varicela y fiebre persistente, lo que ocasionó un sobreabuso de nimesulida. A su llegada al servicio de urgencias se encontraba hipotensa, con taquicardia e indiferencia al medio, sin presentar micción en las últimas 24 horas. A su exploración física presentaba ictericia ++, lesiones dérmicas impetiginizadas y microabscesos en cuello, tórax anterior y posterior. Se inició manejo intensivo con cristaloides, inotrópicos y antimicrobianos. Fue referida a la unidad de terapia intensiva, donde falleció por falla orgánica múltiple, con predominio de encefalopatía hepática, probablemente secundaria al sobreabuso de antiinflamatorio no esteroideo (AINE). Los cultivos de orofaringe y de lesiones impetiginizadas reportaron crecimiento de Staphylococcus aureus.
Conclusión. En todos los casos de varicela, se requiere adecuada monitorización y tratamiento oportuno ante la más mínima sospecha de infección sobreagregada o datos de alarma. La nimesulida no está indicada como AINE en menores de 12 años.
Palabras clave: Varicela; Niño; /complicaciones; Staphylococcus aureus; Falla Hepático
ABSTRACT
Introduction. Chickenpox is an apparently benign viral disease, however, when it causes complications, its morbidity and mortality is high.
Clinical case. An immunocompetent, 3-year-old female preschooler with no history of immunization for chickenpox, who had a typical case of chickenpox and persistent fever, resulting in an overabuse of nimesulide. On arrival at the emergency department, she was hypotensive, tachycardia and indifferent to the environment, with no urination in the last 24 hours. Physical examination showed jaundice +++, impetigenized dermal lesions and microabscesses in the neck, anterior and posterior thorax. Intensive management with crystalloids, inotropics and antimicrobials was initiated. She was referred to the intensive care unit, where she died of multiple organ failure, with a predominance of hepatic encephalopathy, probably secondary to non-steroidal anti-inflammatory drug (NSAID) overuse. Cultures of oropharyngeal and impetigenized lesions reported growth of Staphylococcus aureus.
Conclusion. In all cases of chickenpox, adequate monitoring and timely treatment is required in the event of the slightest suspicion of over-aggregated infection or alarm data. Nimesulide is not indicated as an NSAID in children under 12 years of age.
Key words: Chickenpox; Child; /complications; Staphylococcus aureus; Liver Failure
INTRODUCCIÓN
La varicela es una enfermedad exantemática cuyo agente etiológico es el virus de la varicela zóster (VVZ), perteneciente a la familia de los herpesvirus, y causante también de herpes zóster. Este padecimiento es prevalente en todo el mundo, sobretodo en las temporadas de invierno y primavera (1-4). Es una infección altamente contagiosa y clasificada como benigna; sin embargo, puede ser grave e inclusive mortal, especialmente en recién nacidos y lactantes, adolescentes, mujeres embarazadas, adultos y personas con inmunodeficiencias. Las complicaciones graves de la varicela incluyen: infecciones bacterianas secundarias -sobre todo en piel y tejido blandos-, infecciones del sistema nervioso central (SNC), alteraciones respiratorias, osteoarticulares e inclusive pancreáticas (5-13).
Actualmente, la varicela es una enfermedad prevenible por vacunación, pues ésta cursa con un espectro de complicaciones muy amplio, por lo que el objetivo definido por la Organización Mundial de la Salud (OMS) es de al menos un 85% de cobertura vacunal entre los 12 y 18 meses, esto con el fin de disminuir el número de casos, su gravedad, los gastos directos generados por el cuidado médico y los gastos indirectos sociales relacionados con la enfermedad y la hospitalización. La vacuna para la varicela –al igual que la hepatitis A y meningococo- no forma parte de la Cartilla Nacional de Vacunación en México, y además muchas personas no tienen acceso a la vacunación privada (1).
En México, el 90% de la población ha reportado tener varicela antes de los 15 años de edad y este porcentaje aumenta hasta un 95% en el inicio de la edad adulta. Asimismo, la tasa de ataque secundaria entre hermanos susceptibles es del 70-90%. El comportamiento es cíclico, cada cuatro o cinco años se presenta un aumento en su incidencia y la edad y sexo no varían con lo descrito en la literatura mundial (3).
El Boletín Epidemiológico del Sistema Nacional de Vigilancia Epidemiológica reportó en su Sistema Único de Información 2018, con información preliminar al corte de la semana epidemiológica 13, un total de 39.370 casos nuevos de varicela en México, en comparación con 49.769 casos acumulados durante el 2017. Los estados de Ciudad de México, Estado de México, Jalisco, Nuevo León, Tamaulipas y Veracruz son los que presentan mayor prevalencia. En San Luis Potosí se reportaron 1.282 casos, mientras que Oaxaca fueron 759 casos (4).
La infección se transmite por gotitas de saliva, se distribuye por ganglios linfáticos regionales y posteriormente ocurre la viremia. El cuadro clínico inicial presenta fiebre, cefalea, malestar general, mialgias y artralgias. Entre 24 y 48 horas posteriores, aparecen máculas/pápulas pruriginosas que se convierten en vesículas y costras, principalmente en piel cabelluda, cara, tronco y más tarde en extremidades. Existe una convivencia de lesiones en distintos estadios por lo que se denomina tradicionalmente en cielo estrellado. En ocasiones, se observa un enantema con erosiones en orofaringe, conjuntiva o mucosa vaginal. Las lesiones dérmicas pueden dejar cicatrices deprimidas, hiper o hipopigmentadas (2). (Figura No. 1).
Figura 1. Historia natural de la Varicela.
La varicela remite espontáneamente en la mayoría de los pacientes; sin embargo, en algunos casos, se puede complicar. La sobreinfección bacteriana de las lesiones dérmicas por Staphylococcus aureus o a estreptococcus beta hemolítico del grupo A (SBHGA) es la complicación más frecuente (2,5). En la experiencia pediátrica de los autores del presente caso clínico, la etiología por Staphylococcus aureus no es la más frecuente, por lo que se tiene concordancia con la literatura a lo descrito en infecciones de piel y tejidos blandos.(15)
Los pacientes con sobreinfección bacteriana pueden cursar con celulitis (complicación asociada al consumo de AINE), fascitis necrosante, bacteriemia, neumonía (mas común en adultos, hasta 20%), artritis u osteomielitis (4,5). La afección neurológica sigue en frecuencia: encefalitis, meningoencefalitis, ataxia cerebelosa, mielitis transversa o síndrome de Guillain-Barré (2,4). Es una complicación sobre todo en edad infantil, la encefalitis es la más frecuente y ocurre en los primeros siete días de la aparición del exantema (6). Se estima una incidencia de 1-2 casos por cada 10,000 casos de varicela. Dependiendo de la afección del virus en el SNC se describen tres patrones clínicos diferentes. La púrpura fulminante es una complicación rara y potencialmente mortal; aparece en las primeras dos semanas después del inicio del exantema y la frecuencia en el mundo oscila entre 2 y 5% (5).
Se reporta el presente caso, el cual cursó con falla hepática y encefalopatía secundaria, situación sumamente rara probablemente relacionada con el virus de la varicela y agravada por el uso de nimesulide.
CASO CLINICO
Femenino de tres años de edad, nacida por parto eutócico, en centro de salud suburbano, segunda gesta bajo control prenatal aparente sin complicaciones, peso al nacer de 2.900 g., talla de 49 cm; alimentada con leche materna, ablactación a los seis meses, con esquema de inmunización completo según la cartilla mexicana de salud. Tiene antecedente de exposición de dos familiares con varicela una semana previa al inicio de su padecimiento actual.
Inició su padecimiento actual 10 días previos a su valoración, con alzas térmicas no cuantificadas. Dos días posteriores presentó pápulas y vesículas en tórax, que evolucionaron a costras y se diseminó al resto del cuerpo, por lo que acudió con facultativo quien inició tratamiento con nimesulida (5 ml cada 8 horas) y otros no especificados por cinco días. Se controló la hipertermia; sin embargo, cuatro días previos, inició con hiporexia, somnolencia, ictericia y coluria, la cual se intensificó y acudió a valoración a unidad médica. Refirió última micción veinticuatro horas previas a su ingreso.
A su ingreso peso de 13.600 g, afebril (35.4 °C axilar), somnolienta con tendencia al estupor, indiferente al medio Glasgow modificado de 11 puntos, tensión arterial de 60/20 mmHg, mucosas secas, ictericia ++, lesiones dérmicas en toda su extensión, escasas vesículas, la mayor parte en estadio de costra, algunas lesiones con secreción purulenta (figura 2). Presenta escara en región infra clavicular derecha con eritema circundante (figura 3). Campos pulmonares con estertores gruesos, ruidos cardiacos disminuidos de intensidad no soplos, saturación de oxígeno al 89%. Abdomen con distensión abdominal, peristalsis disminuida, a la palpación hepatomegalia de 6x6x6 cm sobre líneas convencionales (figura 4). Extremidades con edema distal, llenado capilar disminuido mas de 3 segundos, reflejos de estiramientos muscular +/++++. Genitales con leucorrea fétida.
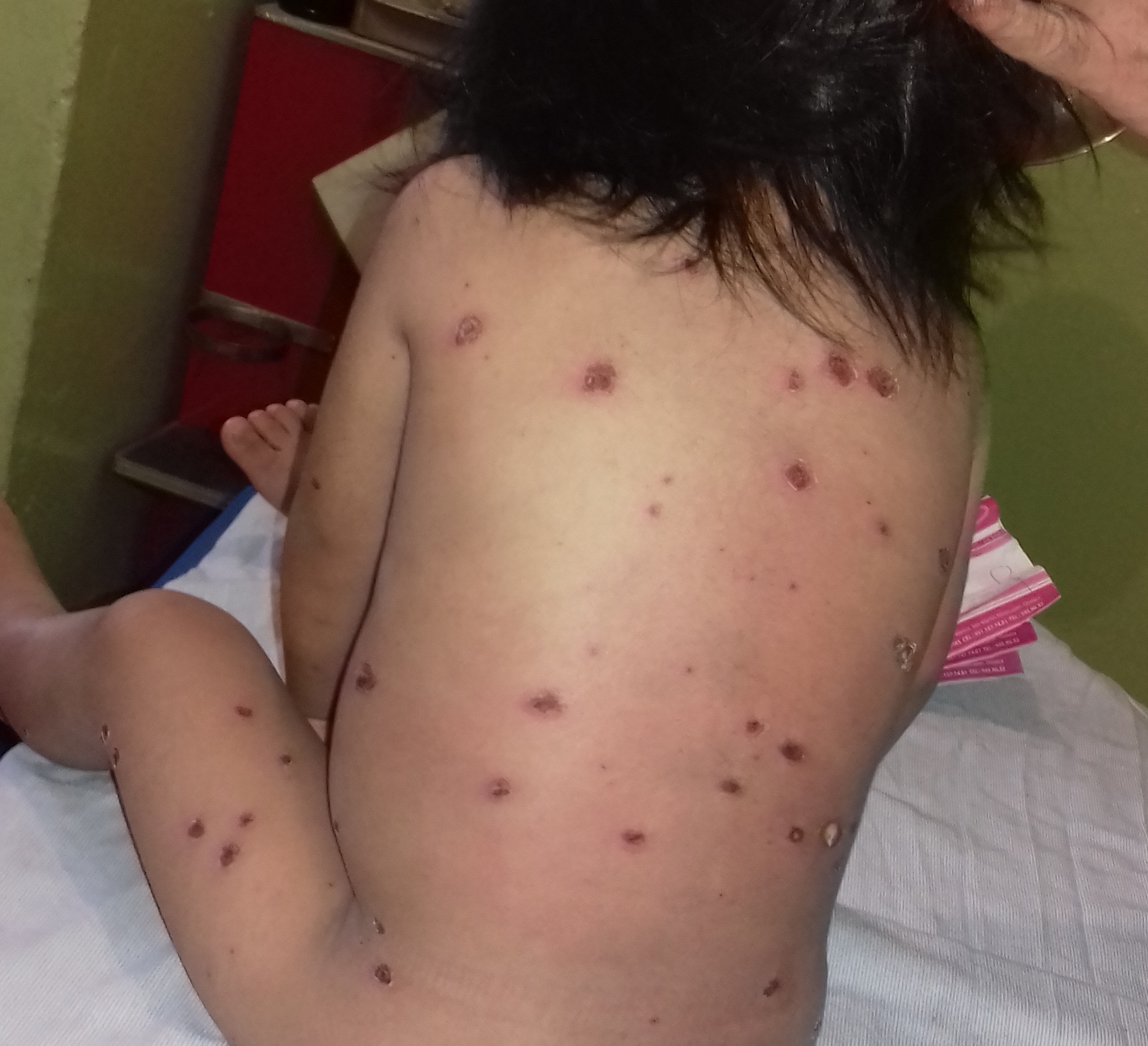
Figura 2. Lesiones costrosas, algunas con secreción purulenta.
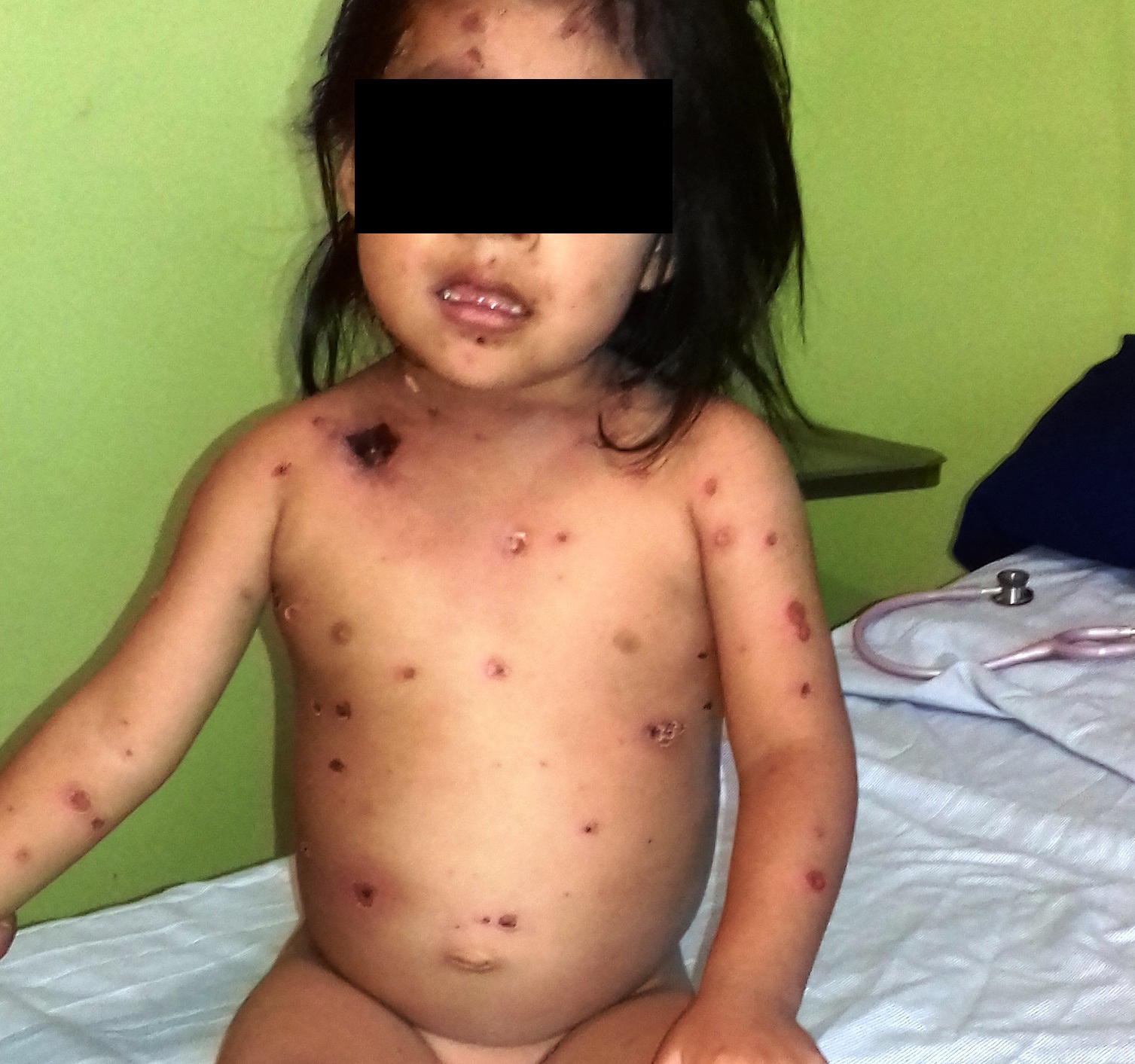
Figura 3. Escara en región clavicular derecha.
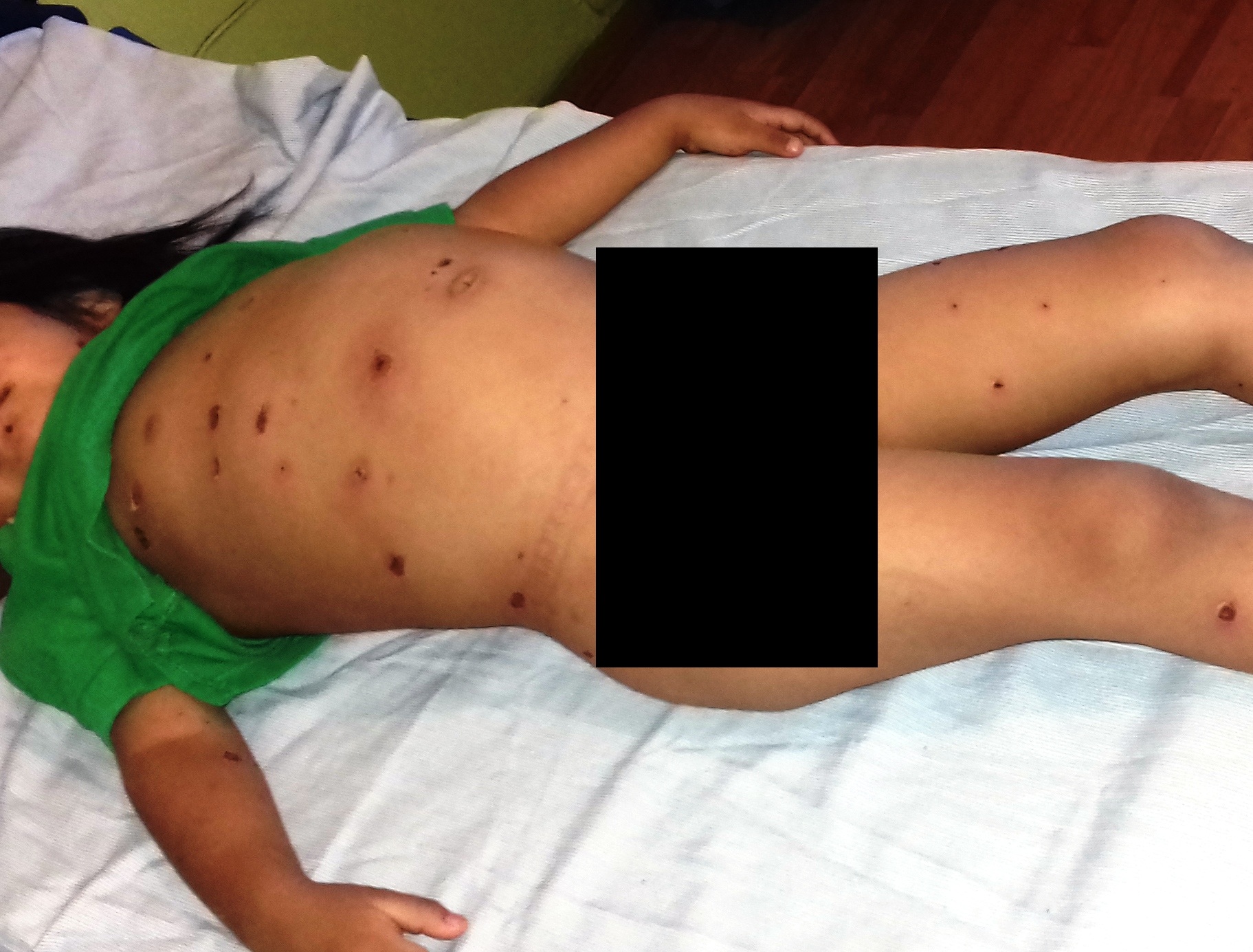
Figura 4. Abdomen globoso por hepatomegalia.
Los estudios de laboratorio mostraron: proteína C reactiva (PCR): 25mg/L, citometría hemática con: Hb 8.3 gr/L; Hto 26,6%; plaquetas 192 000 mm3; leucocitosis de 14,500 a expensas de neutrofilia de 80%, con 74% segmentados y 6% bandas y linfocitos 16%.
Tiempo de protrombina de 28 seg. (normal: 12-14 seg); bilirrubina total 8.5 mg/dl (normal 0.2 a 1 mg/dl); bilirrubina directa 6.5 mg/dl (normal 0-0.4 mg/dl); bilirrubina indirecta 2.0 mg/dl (normal 0 a 0.6 mg/dl); GGT 626 UI/L (normal 8-37 UI/L); colesterol 182 mg/dl; triglicéridos 186 mg/dl; albúmina 3,34 gr/dl (normal 3.4 – 5.0 g / dl) y gammaglobulinas 1,26 g/dl. Los marcadores virales A, B, C, VIH, CMV, Epstein-Barr fueron negativos. Se cultivó secreción de escaras y orofaringe con reporte posterior de S. aureus.
Por el estado clínico de la paciente, se refirió a una unidad de terapia intensiva, previo consentimiento bajo información, en donde, pese al manejo multidisciplinario (cristaloides, inotrópicos, antibióticos, lactulosa, plasma fresco, sangre, etc), falleció diez horas después con diagnóstico final de shock séptico secundario a varicela complicada, encefalopatía hepática probablemente toxica por nimesulida, con principales fallas orgánicas documentadas: falla hepática y cerebral, la familia no aceptó la autopsia.
DISCUSIÓN
En los casos de varicela se estima que el riesgo de complicaciones es mayor en los periodos de reactivación, como lo es el herpes zoster, y éste tiene un mayor riesgo de presentación cuando la primoinfección ocurre en el primer año de vida, en mayores de 60 años, o en estados de inmunosupresión por medicamentos o enfermedad (específicamente en asociación con el virus de inmunodeficiencia humana, neoplasias, etc) (7). En el presente caso, el factor de riesgo mas importante lo fue el uso del nimesulide, ya que la paciente presentaba fiebre persistente, indicando de alguna manera que la varicela no fue la única causa de este síntoma, sino una complicación como la impeteginización de las lesiones, probablemente relacionadas con el rascado y la colonización de Staphylococcus aureus, flora oportunista en piel y tejidos blandos.
El diagnóstico de la varicela es clínico pero puede complementarse con una prueba rápida de Tzanck, que consiste en realizar un raspado de la base de la lesión y observar células gigantes multinucleadas. Sin embargo, esta prueba no es específica del virus de la varicela-zóster. El tratamiento de la varicela en niños sanos es sintomático.(2)
Hablando de antitérmicos, en pediatría únicamente se recomiendan dos antiinflamatorios no esteroideos (AINES): el paracetamol y el ibuprofeno. Otros están altamente contraindicados, como por ejemplo, el uso del ácido acetilsalicílico, por su asociación con síndrome de Reye y la nimesulida, contraindicado su uso en menores de 12 años de edad por su asociación con falla hepática (16,17). El tratamiento antiviral únicamente se recomienda en personas con riesgo de tener una varicela de moderada a grave (pacientes mayores de 12 años de edad, pacientes con enfermedad cutánea o pulmonar crónica o en tratamiento crónico con salicilatos o corticoesteroides) (2). En pacientes con encefalitis por virus de varicela-zoster, aunque no existen ensayos clínicos controlados aleatorizados, se emplea aciclovir intravenoso (10 mg/kg/8 h) durante 14-21 días. En los casos de arteritis, se suelen adicionar corticoesteroides (recomendación C, basada en opiniones de expertos o estudios descriptivos) (6). En personas susceptibles, con exposición conocida al virus, se puede aplicar gammaglobulina para varicela zóster en las primeras 48-96 horas de exposición, o bien la administración de la vacuna (2).
La nimesulida es un AINE que pertenece a la clase de las sulfonamidas, con potente acción antiinflamatoria, analgésica y antipirética. Se comporta como inhibidor selectivo de la ciclooxigenasa tipo 2 (Cox-2). Su farmacodinamia le confiere escasa tendencia a efectos adversos gastrointestinales; sin embargo, es un fármaco asociado con elevación de enzimas hepáticas hasta falla hepática aguda (18). Los mecanismos patogénicos del daño hepatocelular inducido por la nimesulida se encuentran en debate. Se han discutido las reacciones idiosincrásicas, los mecanismos tóxicos alérgicos o dependientes de la dosis. Sin embargo, parece probable que estén involucradas tanto reacciones metabólicas idiosincrásicas como inmunológicas. Este punto está respaldado por el retraso relativamente prolongado entre el inicio de la nimesulida y el desarrollo de daño hepático, un periodo variable entre 1 a 5 semanas que reaparece tras la readministración del fármaco y que puede acompañarse por fiebre, exantema cutáneo, eosinofilia y un infiltrado eosinofílico o granulomatoso hepático (18,19).
La nimesulida es degradada a nivel hepático a varios metabolitos, en concreto, el 4 hidroxi-nimesulida, y estos son excretados por orina y heces. Rutas metabólicas aberrantes del fármaco en pacientes susceptibles inducirían la aparición de metabolitos hepatotóxicos. Los modelos de lesión hepática más frecuentes asociados a la administración de AINE, tienen diferente distribución en función del sexo, las mujeres se caracterizan por necrosis hepatocelular. En cambio en los varones, la lesión predominante es una hepatitis colestásica pura centrolobulillar, distribución no vista con el uso de otros AINE.(18, 20-23)
La distribución preferente centrolobulillar de la lesión sugiere una posible implicación de la enzima citocromo P450. La actividad de esta enzima es más alta en esta región, y se ha propuesto que los metabolitos anormales ejercen un efecto tóxico directo o inducen reacciones inmunológicas anormales formando ductos con el complejo citocromo P450. La colestasis podría inducir la acumulación de metabolitos tóxicos e incrementar la susceptibilidad para el desarrollo de las lesiones hepáticas.(18,19)
A pesar de su aparente benignidad, la morbilidad y los gastos directos e indirectos sociales relacionados con la enfermedad y posibles complicaciones, apoyan la introducción de la vacunación universal en el esquema, misma que se pretende apoyar con el presente artículo. Al momento, hacen falta publicaciones sobre la epidemiología de la enfermedad y el amplio espectro de complicaciones en México. Pese a la disposición en el mercado de presentaciones infantiles de nimesulide, este fármaco no se recomienda en menores de 12 años y no se encuentra dentro del listado de principios activos aprobados por la Food and Drug Administration (FDA), ni por la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris). Se asocia a un mayor riesgo, en términos de frecuencia y gravedad, de inducir lesiones hepáticas, comparado con otros AINE, desafortunadamente no se cuenta con evidencias hepáticas de biopsias para haber documentado científicamente el daño hepático originado por este fármaco. (16,17,24)
Este caso fatal se une a muchos mas que se seguirán presentando y que incrementan los índices de muerte a esta edad. A manera de reflexión, es necesario concientizar a las autoridades que marcan las políticas de salud en México (gobernantes, diputados, secretarios y subsecretarios de salud, etc.) el ya no postergar mas la vacunación universal de varicela e incluirla en la Cartilla Nacional de Vacunación mexicana, propuesta realizada ya hace algunos años ante las instancias gubernamentales con nula respuesta.(25)
CONCLUSIONES
Los profesionales de la salud deberán mantener la vigilancia y no subestimar el curso benigno de la varicela en pacientes aparentemente sanos, a pesar de que según la bibliografía, las complicaciones son más comunes en casos de reactivaciones como herpes zóster y no como primo infección. Sin duda, las complicaciones no son mínimas y la mortalidad es elevada una vez que éstas se presentan
REFERENCIAS
- París EC, Rubio JM, García MM, Arriola PG, Jiménez BJ. Revisión de 5 años de las varicelas que requirieron ingreso en nuestro hospital. Rev Esp Ped 2011; 67(5): 261-265.
- Palacios LG, Durán MC, Orozco CL, Saéz OM, García RT, Ruiz MR. Exantemas en pediatría Acta Ped Mex 2015; 36: 412-23.
- Cabrera GA, Muñoz MW, Gómez AM. Comportamiento epidemiológico de la varicela en México: 18 años de estudios y estimaciones para los próximos cinco años; Rev Enf Infec Ped 2009; 22 (87): 77-82.
- Pérez YG, Arranzb L, Alustizac J, Azkunagad B, Uriza J, Sarasuaa A. Mendiburue I, Emparanzaf JI. Hospitalizaciones por complicaciones de la varicela en niños menores de 15 años. Anales de Pediatría (Barcelona) 2003; 59(3): 229-33.
- Delfín-S Y L; Huerta G G C; Miranda-N M G; Pacheco-R D; Solórzano-S F; Frecuencia y características clínicas de las infecciones de la piel y tejidos blandos en niños con varicela; Enf Inf Microb 2009; 29 (3): 94-8.
- García MC. Encefalitis agudas Neurología 2010; 25(Supl 1): 11-7.
- González SN, Macías PM, Monroy CV, Escárcega JS, Estudillo JE, Piña RG. Herpes zoster y encefalitis: Reporte de un caso y revisión de la literatura; Rev de Enf Infec Ped. 2013; 27: 105-8.
- Prego J, Sehabiague G, de Leonardis D y cols. Varicela complicada con fascitis necrotizante. Importancia de un diagnóstico oportuno Arch Pediatr Urug 2001; 72(1): 85-89.
- Reyes GU, Pérez PO, Ramírez PB, Reyes HU, Reyes HD, Ibañez CM. Pancreatitis asociada a varicela. Reporte de un caso pediátrico Enf Inf Microbiol 2009; 29(3): 119-22.
- Martínez RE, Reyes GU, García SE, López CG, Pérez PO. Varicela congénita: reporte de un caso Rev Mex Ped 2015; 82(1): 32-5.
- Reyna FJ, Ortiz IFJ, Pérez AB. Lesiones cutáneas no cicatrizales como único dato clínico del síndrome de varicela congénita: reporte de un caso. Bol Med Hosp Inf Mex. 2006; 63: 264-267.
- Reyes GU, López CG, Sánchez CN, Córdova MA, Velasco MA, García GJ. “Absceso muscular post-varicela en pediatría. Análisis de un caso”. Rev Mex Puer Pediat 2003; 10 (59): 140-4.
- García GJ, Sánchez MU, Reyes GU, López CG. Varicela neonatal. Informe de dos casos clínicos”. Rev Mex Puer Ped 2003; 10 (59): 145-150.
- Boletín Epidemiológico del Sistema Nacional de Vigilancia Epidemiológica Sistema Único de Información [Internet]. Gob.mx. 2018 [citado 11 April 2018]. Disponible en: https://www.gob.mx/cms/uploads/attachment/file/314582/sem13.pdf
- Reyes HK, Reyes HD, Reyes GU, Santamaría AC, Reyes HM, Baltazar HF, et al. Absceso de cuello por Streptococcus pyogenes como complicación de varicela. Reporte de caso. Enfermedades Infecciosas y Microbiología. 2016; 36(3):89-93.
- Gupta P, Sachdev HP. Safety of oral use of nimesulide in children: systematic review of randomized controlled trials. Indian Pediatr. 2003 Jun;40(6):518-31.
- Verver y Vargas DA, Pérez VA. Oficio No 356 [Internet]. Ciudad de México: Cofepris; 2012 [citado 11 April 2018]. Disponible https://www.anafarmex.com.mx/wp-content/uploads/2012/11/Oficio-356.pdf
- C Ferreiro, S Vivas, F Jorquera, AB Domínguez, J Espinel, F Muñoz, A Herrera, MJ Fernández, JL Olcoz, J Ortiz de Urbina; Hepatitis tóxica por nimesulida. Presentación de un nuevo caso y revisión de la bibliografía; Gastroenterol Hepatol 2000;23:428-30.
- Stadlmann S, Zoller H, Vogel W, Offner F. COX-2 inhibitor (nimesulide) induced acute liver failure. Virchows Archiv. 2002;440(5):553-555.
- Van Steenbergen W, Peters P, De Bondt J,Staessen D, Buscher H, Laporta T, et al. Nimesulide-induced acute hepatitis: evidence from six cases. J Hepatol 1998;29:135-141.
- Romero M, Nevado M, Otero MA, Fovelo MJ, Suárez E, Castro M. Acute cholestatic hepatitis induced by nimesulide. Liver 1999;19:164-5.
- McCormick PA, Kennedy F, Curry M, Traynor O. COX-2 inhibitor and fulminant hepatic failure. Lancet 1999;353:40-1.
- Andrade R, Lucena MI, Fernández MC, González M. Fatal hepatitis associated with nimesulide. J Hepatol 2000;32:174.
- Traversa G. Cohort study of hepatotoxicity associated with nimesulide and other non-steroidal anti-inflammatory drugs. BMJ. 2003;327(7405):18-22.
- Reyes GU. Plan de trabajo del capítulo centro 2012 La importancia de no postergar mas la inclusión de la vacuna de varicela Cepa OKA a la cartilla nacional de vacunación, justificaciones que lo avalan. Academia Mexicana de Pediatría.




