AEROMONAS HYDROPHILA IN SEAFOOD OF ANIMAL ORIGEN FROM ESTABLISHMENTS OF PUERTO ANGEL, OAXACA, MEXICO
José Franco-Monsreal 1, Erika Beatriz Lara-Zaragoza2, Nemesio Villa-Ruano2, Lizbeth Mota-Magaña2; José Ricardo Hernández-Gómez 1, Lidia Esther del Socorro Serralta-Peraza1
1 Universidad Intercultural Maya de Quintana Roo. México.
2 Universidad de la Sierra Sur. Oaxaca, México.
Correspondencia: José Franco-Monsreal. Departamento de Salud y Desarrollo Comunitario. Universidad Intercultural Maya de Quintana Roo. México. Correo electrónico: jose.franco@uimqroo.edu.mx
RESUMEN
Introducción. Dentro del género Aeromonas la especie hydrophila es una de las tres especies de importancia clínica. El espectro de infecciones humanas causado por esta especie incluye gastroenteritis aguda (GA), infección de herida (IH), infección urinaria (IU), septicemia primaria (SP) y septicemia secundaria (SS). El objetivo del estudio fue identificar si los alimentos marinos de origen animal –crudos (C), marinados sin calor (MSC), parcialmente cocidos con calor (PCCC) y completamente cocidos con calor (CCCC)- que se expenden en establecimientos de Puerto Ángel, Oaxaca, México, representan factores potenciales de riesgo por la especie Aeromonas hydrophila para el desarrollo de GA, IH, IU, SP y SS.
Material y Métodos. Estudio observacional descriptivo de corte transversal en el cual se estudiaron 400 muestras. [325 (81,25%) C, 17 (4,25%) MSC, 18 (4,50%) PCCC y 40 (10,00%) CCCC]. Para la homogeneización y el enriquecimiento de las muestras, así como para el aislamiento y la identificación de la especie Aeromonas hydrophila se procedió según la metodología descrita en el Manual Analítico Bacteriológico (Agencia de Alimentos y Medicamentos). Como prueba de significación estadística se utilizó la Ji-cuadrada de Mantel-Haenszel (x²M-H).
Resultados. Las prevalencias obtenidas en alimentos marinos C, MSC, PCCC y CCCC fueron, respectivamente, 49,54% (161/325), 35,29% (6/17), 27,78% (5/18) y 15,00% (6/40). En 178 (44,50%) muestras se aisló un número igual de cepas cuyas características bioquímicas correspondieron a la especie Aeromonas hydrophila.
Conclusiones. Se concluye que los alimentos marinos C, MSC, PCCC y CCCC representan factores potenciales de riesgo por la especie Aeromonas hydrophila para el desarrollo de GA, IH, IU, SP y SS en Puerto Ángel, Oaxaca, México.
Palabras clave: Aeromonas hydrophila, noxas, alimentos marinos
ABSTRACT
Introduction. Within the genus Aeromonas the hydrophila species is one of three clinically important. The spectrum of human infections caused by this species include acute gastroenteritis (AG), wound infection (WI), urinary tract infection (UTI), primary septicemia (PS) and secondary septicemia (SS). The objective of the study was to identify whether seafood -raw, marinated without heat, partially cooked with heat and completely cooked with heat- that are sold in stores of Puerto Angel, Oaxaca, Mexico, represent potential risk factors for the Aeromonas hydrophila species for development of AG, WI, UTI, PS and SS.
Material and Methods. A descriptive observational cross-sectional study in which four hundred samples were studied. [325 (81,25%) raw, 17 (4,25%) marinated without heat, 18 (4,50%) partially cooked with heat and 40 (10,00%) completely cooked with heat]. For homogenization and enrichment of the samples, as well as for the isolation and identification of Aeromonas hydrophila species proceeded according to the methodology described in the Bacteriological Analytical Manual (Food and Drug Administration). As statistical significance test Chi-square Mantel-Haenszel (x²M-H) was used.
Results. The prevalences obtained in raw, marinated without heat, partially cooked with heat and completely cooked with heat seafood were, respectively, 49,54% (161/325), 35,29% (6/17), 27,78% (5/18) and 15,00% (6/40). In one hundred seventy eight (44,50%) samples an equal number of strains whose biochemical characteristics corresponded to the Aeromonas hydrophila species were isolated.
Conclusions. We conclude that raw, marinated without heat, partially cooked with heat and completely cooked with heat seafood represent potential risk factors for Aeromonas hydrophila species for the development of AG, WI, UTI, PS and SS at Puerto Ángel, Oaxaca, México
Keywords: Aeromonas hydrophila, noxae, seafood
INTRODUCCIÓN
El medio marino ocupa cerca de 71% de la superficie terrestre y en las zonas costeras se relaciona con el hombre directamente por razones laborales y/o deportivas, o indirectamente por la manipulación y/o por el consumo de productos del mar (1).
En la segunda edición del Manual de Bergey de Bacteriología Sistemática, la Familia Aeromonadaceae pertenece al Orden XII (Aeromonadales) de la Clase III (Gammaproteobacteria) del Phylum BXII (Proteobacteria) del Dominio Bacteria. A su vez, la Familia Aeromonadaceae se encuentra integrada por los géneros Aeromonas, Oceanimonas, Oceanisphaera y Tolumonas. De las diecinueve especies del género Aeromonas, las siguientes tres se consideran patógenas para el ser humano: Aeromonas hydrophila, Aeromonas caviae y Aeromonas veronii (2).
Las enfermedades infecciosas constituyen uno de los principales problemas a los que se enfrentan los países en vías de desarrollo. En México, la población rebasa más de 90 millones de habitantes y las condiciones socioeconómicas del país favorecen que las enfermedades gastrointestinales sean un grave problema de salud pública. Éstas afectan principalmente a la población infantil, siendo la diarrea la manifestación más frecuente (3).
Las enfermedades diarreicas muestran una variación estacional con un aumento en el número de casos en las estaciones primavera-verano, y la Secretaría de Salud reportó en el periodo 1998- 2001 más de 5 millones 500 mil casos anuales (4).
Los agentes etiológicos asociados a dichas infecciones son las bacterias, los parásitos y los virus, siendo las bacterias y los parásitos los principales agentes causales de estos procesos en México y en el mundo. En México, las bacterias más frecuentemente involucradas en las diarreas son Salmonella, Shigella, algunos serotipos de Escherichia coli y Campylobacter jejuni (3).
El acelerado avance tanto en las técnicas de aislamiento como de identificación bacteriana ha permitido añadir a esta lista otros agentes etiológicos, entre los que destacan las especies del género Aeromonas, las cuales han adquirido importancia sanitaria al ser también capaces de producir infecciones de heridas, e incluso, infecciones respiratorias (5-6).
En México, los estudios para determinar la incidencia del género Aeromonas son escasos, destacando los realizados por Rebollo y Escamilla (7); dichos investigadores aislaron Aeromonas con una frecuencia del 7,7% en casos de diarrea aguda en niños menores de 2 años de edad, y en un 7% en adultos, mientras que en estudios posteriores demostraron que 5,7% de los aislamientos que procedían de niños menores de 5 años de edad, con diarrea de larga evolución, pertenecían a Aeromonas (7-8).
La prevalencia de las especies de Aeromonas en el ambiente, especialmente en el medio acuático, y el aumento tanto del espectro como del número de infecciones asociadas a este género en las últimas décadas, ha generado un interés creciente para establecer el riesgo que representa para la salud pública (3).
Un trabajo de investigación reporta el estudio de 432 muestras representativas. Doce (9,23%) de las 130 muestras de alimentos marinos crudos, 0 (0,00%) de las 20 muestras de alimentos marinos marinados sin calor, 9 (4,57%) de las 197 muestras de alimentos marinos parcialmente cocidos con calor y 0 (0,00%) de las 85 muestras de alimentos marinos completamente cocidos con calor resultaron positivas (9).
Asimismo, la especie Aeromonas hydrophila se encuentra relacionada con gastroenteritis aguda, infección de herida, infección urinaria, septicemia primaria y septicemia secundaria (10).
Franco Monsreal et al., (11) reportan el estudio de 325 muestras seleccionadas aleatoriamente. Nueve (9,18%) de las 98 muestras de alimentos marinos crudos, 0 (0,00%) de las 15 muestras de alimentos marinos marinados sin calor, 7 (4,73%) de las 148 muestras de alimentos marinos parcialmente cocidos con calor y 0 (0,00%) de las 64 muestras de alimentos marinos completamente cocidos con calor resultaron positivas.
De igual manera, otra investigación reporta el estudio de 390 muestras. Trece (9,23%) de las 298 muestras de alimentos marinos crudos, 0 (0,00%) de las 8 muestras de alimentos marinos marinados sin calor, 4 (4,57%) de las 77 muestras de alimentos marinos parcialmente cocidos con calor y 0 (0,00%) de las 7 muestras de alimentos marinos completamente cocidos con calor resultaron positivas (12).
La presente investigación tuvo como objetivo identificar las prevalencias de la especie Aeromonas hydrophila en alimentos marinos crudos (C), marinados sin calor (MSC), parcialmente cocidos con calor (PCCC) y completamente cocidos con calor (CCCC). En otras palabras, determinar si los alimentos marinos C, MSC, PCCC y CCCC representan factores potenciales de riesgo por la especie Aeromonas hydrophila para el desarrollo de gastroenteritis aguda (GA), infección de herida (IH), infección urinaria (IU), septicemia primaria (SP) y septicemia secundaria (SS) (10).
MATERIAL Y MÉTODOS
Diseño de estudio
Estudio epizootiológico observacional descriptivo de corte transversal.
Universo de estudio
El estudio se realizó con el total de muestras (400) del total de establecimientos especializados (38) en la venta de alimentos marinos para consumo humano en Puerto Ángel, Oaxaca, México (Figura 1) (13), en el período comprendido del 1 de febrero de 2011 al 31 de enero de 2012. La recolección de las muestras se llevó a cabo del 1 de marzo de 2011 al 31 de agosto del mismo año.
Definiciones operacionales de las variables
Establecimientos (coctelerías pescaderías y restaurantes). Establecimientos que expenden alimentos marinos de origen animal para consumo humano y que cuentan con licencia sanitaria expedida por la Secretaría de Salud del estado de Oaxaca.
Según su método de preparación, en el presente estudio los alimentos marinos fueron clasificados en C, MSC, PCC y CCCC.
Alimento marino. Cualquier producto de origen animal, procedente del mar, que proporcione al organismo humano elementos para su nutrición.
Alimento marino crudo. Cualquier producto de origen animal, procedente del mar, que proporcione al organismo humano elementos para su nutrición y que en el momento del muestreo haya sido encontrado en su estado natural.
Alimento marino marinado sin calor. Cualquier producto de origen animal, procedente del mar, que proporcione al organismo humano elementos para su nutrición y que en el momento del muestreo haya sido encontrado cocido utilizando la acción del ácido del jugo de limón.
Alimento marino parcialmente cocido con calor. Cualquier producto de origen animal, procedente del mar, que proporcione al organismo humano elementos para su nutrición y que en el momento del muestreo haya sido encontrado preparado de la siguiente manera: a) Calentar agua hasta ebullición; b) apagar la fuente de calor y adicionar el alimento marino; c) dejar "ablandar" el alimento marino en el agua caliente durante 5 minutos; y d) transferir el alimento marino a un recipiente, dejándolo reposar hasta enfriamiento. Este alimento se encuentra listo para ser utilizado en la preparación de cócteles y/o ceviches.
Alimento marino completamente cocido con calor. Cualquier producto de origen animal, procedente del mar, que proporcione al organismo humano elementos para su nutrición y que en el momento del muestreo haya sido encontrado cocido, utilizando la acción del calor (asado a la parrilla, frito y vapor de agua, entre otros).
Técnicas y procedimientos
Se proporcionó a los autores de este estudio un listado de 38 establecimientos (coctelerías, pescaderías y restaurantes) especializados en la venta de alimentos marinos para consumo humano. Se realizó una primera visita a cada uno de los establecimientos y se compiló una lista de 400 muestras de alimentos marinos que, según su método de preparación, fueron clasificados en C, MSC, PCCC y CCCC. Los establecimientos recibieron una segunda visita (en el periodo del 1 de marzo de 2011 al 31 de agosto del 2011) durante la cual dichas muestras fueron recolectadas.
Cada muestra pesó aproximadamente 50 gramos; se almacenó individualmente en bolsa estéril de polietileno (Ziploc) y se conservó en refrigeración.
Para el enriquecimiento de las muestras se utilizó el agua peptonada alcalina, pH 8.7, la cual ha demostrado ser la mejor elección. Para el aislamiento de la especie Aeromonas hydrophila se utilizó el agar bilis-irgasan-verde brillante (BIVB), el cual ha demostrado ser más efectivo que otros medios de composición similar (14). Las pruebas bioquímicas utilizadas para la identificación de la especie Aeromonas hydrophila fueron las siguientes: Indol, positivo; lisina descarboxilasa (LDC), positivo; ornitina descarboxilasa (ODC), negativo; arginina hidrolasa (ADH), positivo; Voges-Proskauer (VP), positivo; esculina, positivo; β-hemólisis (base de agar adicionado con sangre de carnero 5%), positivo; ácido de sacarosa, positivo; ácido de D-manitol, positivo; ácido de D-sorbitol, negativo; y gas de glucosa, positivo (15).
A pesar de que se han realizado numerosos estudios para elucidar los mecanismos de patogeneidad en las infecciones causadas por el género Aeromonas, actualmente no se ha logrado conciliar los resultados para el establecimiento de dichos mecanismos en forma contundente (15). Sin embargo, ha podido identificarse un gran número de estructuras y enzimas extracelulares, que al parecer tienen un papel importante en la patogeneidad de las infecciones tanto intestinales como sistémicas (15-16).
Algunos factores que se encuentran asociados a virulencia, han sido identificados y caracterizados en estudios tanto in vivo como in vitro, lo cual ha permitido el conocimiento de su función biológica, así como la comparación de la similitud genómica que pudiere existir con otros factores de virulencia reportados para otros agentes bacterianos (17-24).
A continuación se proporciona un breve listado de las estructuras asociadas a la virulencia: cápsula (17-18); capa S (19-20); lipopolisacárido (21); pili (22-24); proteínas de membrana externa (OMP) (25-42); hemolisinas (27-30); enterotoxinas citotónicas (31-33); proteasas (34-35); lipasas (36-39); desoxirribonucleasas (40); y sideróforos (41-42). No fue objetivo del presente estudio la cuantificación de dichos factores de virulencia.
El género Aeromonas se divide en dos grandes grupos con base tanto a la temperatura óptima de crecimiento como a la capacidad de movilidad de las especies. El primer grupo es amplio y heterogéneo genéticamente, y se encuentra constituido por especies mesófilas y móviles que crecen óptimamente a 28°C. El segundo grupo es reducido y homogéneo genéticamente, se designa como grupo psicrófilo cuya temperatura óptima de crecimiento se encuentra entre 22-25°C; se encuentra constituido por la especie Aeromonas salmonicida con las siguientes cinco subespecies: A. salmonicida ssp. salmonicida, A. salmonicida ssp. masoucida, A. salmonicida ssp. achromogenes, A. salmonicida ssp. smithia y A. salmonicida ssp. pectinolytica (43).
Se construyeron tablas de contingencia de 2x2 y tablas de contingencia de 2x4, a partir de las cuales se calcularon las proporciones. Como prueba de hipótesis se utilizó el estadístico Ji-cuadrada de Mantel-Haenszel (x²M-H). Se utilizó el programa Epi Info para Windows, versión 7.1.5.2, para la obtención de los valores de la x²M-H y de la probabilidad (p). El criterio aplicado en la realización de las pruebas de hipótesis para la diferencia entre dos proporciones se basó en las recomendaciones formuladas por Cochran (44): 1. Cuando n40 utilice la prueba x²M-H; 2. Cuando 20n40 utilice la prueba x²M-H si, y sólo si, todas las frecuencias esperadas son ≥ 5; si en alguna celda se encuentra una frecuencia esperada 5 utilice, entonces, la prueba de la probabilidad exacta de Fisher (PPEF); y 3. Cuando n20 utilice la PPEF.
El criterio utilizado en la realización de las pruebas de hipótesis para la diferencia entre tres y más proporciones se basó en las recomendaciones formuladas por Cochran (44): 1. Puede utilizarse la prueba x²M-H si menos del 20% de las celdas tienen frecuencias esperadas < 5 y si no hay celda alguna con frecuencia esperada < 1; 2. Si estos requisitos son no reunidos por lo datos en la forma en que fueron obtenidos originalmente, el investigador, entonces, debe combinar las categorías adyacentes con el objeto de aumentar las frecuencias esperadas en las diferentes celdas; y 3. Sólo después de haber combinado las categorías para reunir los requisitos anteriores puede aplicarse la prueba x²M-H.
Se construyó el intervalo de estimación de Cornfield al nivel de confianza del 95% para el porcentaje en la población de alimentos marinos de origen animal con la especie Aeromonas hydrophila (45).
RESULTADOS
En el cuadro 1 se presentan las frecuencias absolutas y las frecuencias relativas de la especie Aeromonas hydrophila en alimentos marinos según métodos de preparación.
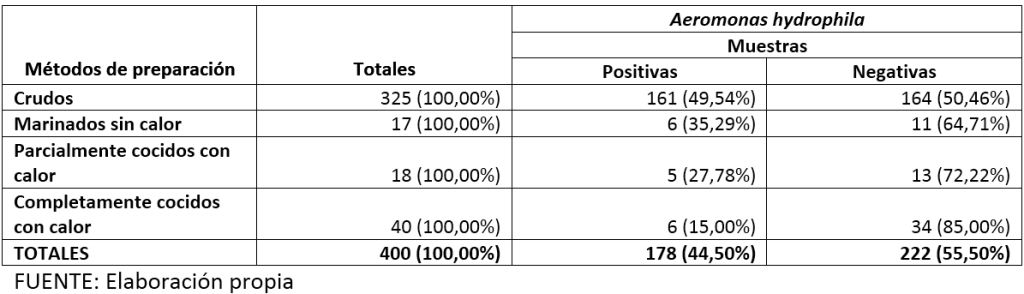
Cuadro 1. Frecuencias absolutas y frecuencias relativas de la especie Aeromonas hydrophila en alimentos marinos según métodos de preparación. Puerto Ángel, Oaxaca, México. 2011.
Las frecuencias relativas de la especie Aeromonas hydrophila en alimentos marinos según métodos de preparación se presentan en la figura 1.
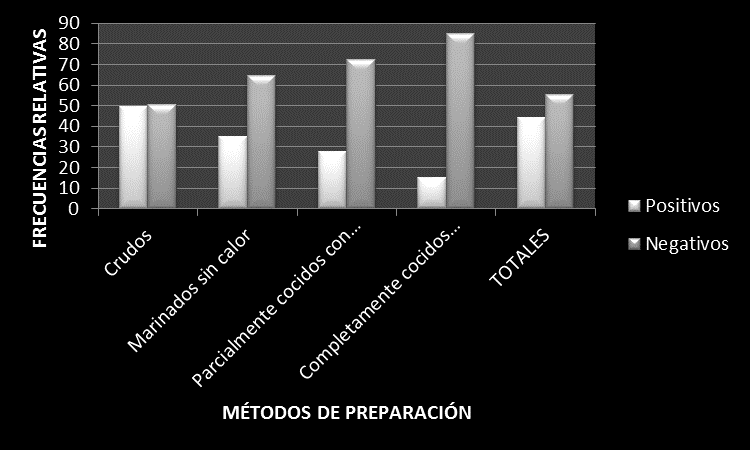
Figura 1. Frecuencias relativas de la especie Aeromonas hydrophila en alimentos marinos según métodos de preparación. Puerto Ángel, Oaxaca, México. 2011.
En el cuadro 2 se presentan los valores de la Ji-cuadrada de Mantel-Haenszel (x²M-H) y de la probabilidad (p), así como la interpretación de los contrastes de las prevalencias observadas de la especie Aeromonas hydrophila según métodos de preparación de los alimentos marinos.
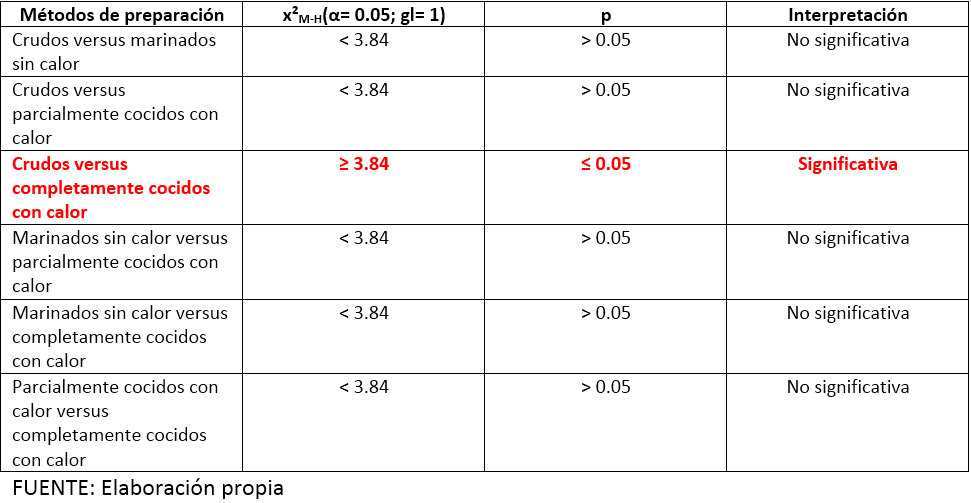
Cuadro 2. Alimentos marinos crudos, marinados sin calor, parcialmente cocidos con calor y completamente cocidos con calor según contraste de las prevalencias observadas. Puerto Ángel, Oaxaca, México. 2011.
Como puede observarse en el cuadro 2 se encontró diferencia estadísticamente significativa cuando se comparó la prevalencia observada en alimentos marinos C (49,54%) versus la prevalencia observada en alimentos marinos CCCC (15,00%): x²M-H(α= 0.05; gl= 1)≥ 3.84; p≤ 0.05.
El intervalo de estimación de Cornfield al nivel de confianza de 95% para el porcentaje en la población de alimentos marinos de origen animal con la especie Aeromonas hydrophila fue 39,63% ≤ P ≤ 49.37%.
En el cuadro 3 se presentan las frecuencias absolutas y las frecuencias relativas de la especie Aeromonas hydrophila en estudios (9,11-12) realizados en tres áreas geográficas, más las del presente estudio, según métodos de preparación.
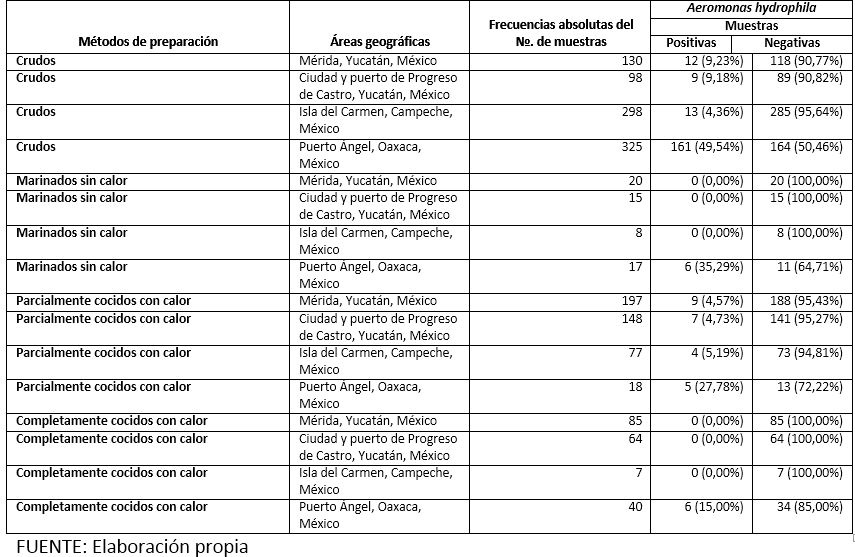
Cuadro 3. Frecuencias absolutas y frecuencias relativas de la especie Aeromonas hydrophila en cuatro áreas geográficas (incluyendo las del actual estudio) según métodos de preparación, áreas geográficas y frecuencias absolutas del número de muestras. Mérida, Yucatán, México. 1/III/1999-15/V/1999*; Ciudad y Puerto de Progreso de Castro, Yucatán, México. 1/I/2007-30/VI/2007*; Isla del Carmen, Campeche, México. 1/VIII/2009-31/III/2010*; Puerto Ángel, Oaxaca, México. 1/III/2011-31/VIII/2011*
DISCUSIÓN
La más alta frecuencia (49,54%) fue observada en los alimentos marinos crudos. En consecuencia, este resultado corresponde al esperado debido a que la probabilidad de aislamiento es alta cuando el alimento no ha sido expuesto a la acción del calor.
En segundo lugar, se tiene la frecuencia (35,29%) observada en los alimentos marinos MSC. Por ende, este resultado corresponde al esperado porque son alimentos que no han sido expuestos a la acción del calor.
En tercer lugar, se tiene la frecuencia (27,78%) observada en los alimentos marinos PCCC. Este resultado no corresponde al esperado y la prevalencia observada puede ser explicada ya sea porque el procedimiento utilizado para "ablandar" el alimento no es suficiente para destruir al microorganismo –suposición que se encuentra apoyada por un estudio, cuyos autores (46) reportan la viabilidad de la especie después de haber mantenido a un crustáceo en agua en ebullición durante 5 minutos, previa inoculación de 0.1 mililitros de caldo de cultivo-, o bien, porque el alimento pudo haber sido contaminado por el manipulador después del proceso de "ablandamiento", ya sea por contaminación cruzada en las cocinas desde otros alimentos, o bien, mediante el mecanismo ano-mano-alimento por ser un portador asintomático –suposición que se encuentra apoyada por estudios (47-49) en los cuales se reporta entre 0,68% y 3,30%, 0,72% y 3,85%, respectivamente, de manipuladores de alimentos marinos que excretan al microorganismo en sus heces.
Finalmente, se encontró una frecuencia de 15,00%, observada en los alimentos marinos CCCC. Subsiguientemente, este resultado tampoco corresponde al esperado porque la probabilidad de aislamiento es nula cuando el alimento ha sido preparado mediante una adecuada exposición a la acción del calor. La frecuencia observada puede ser explicada porque el alimento pudo haber sido contaminado por el manipulador, ya sea por contaminación cruzada en las cocinas desde otros alimentos, o bien, mediante el mecanismo ano-mano-alimento por ser un portador asintomático –suposición que se encuentra apoyada por estudios (47-49) en los cuales se reporta entre 0,68% y 3,30%, 0,72% y 3,85%, respectivamente, de manipuladores de alimentos marinos que excretan al microorganismo en sus heces.
Cuando se realizó el contraste de hipótesis de las prevalencias encontradas en trabajos de investigación (9, 11-12) realizados en cuatro áreas geográficas, incluyendo la actual, se encontró lo siguiente: 1. Se encontró diferencia estadísticamente significativa entre las prevalencias observadas de la especie Aeromonas hydrophila en los alimentos marinos C de las cuatro áreas geográficas: x²M-H(α= 0.05; gl= 3)≥ 7.81; p≤ 0.05; 2. No fue posible el contraste de las prevalencias observadas de la especie Aeromonas hydrophila en los alimentos marinos MSC de las cuatro áreas geográficas debido a que no cumple con las recomendaciones formuladas por Cochran (44); 3. Cuando fueron comparadas las prevalencias observadas de la especie Aeromonas hydrophila en los alimentos marinos PCCC de las cuatro áreas geográficas se encontró diferencia estadísticamente significativa: x²M-H(α= 0.05; gl= 3)≥ 7.81; p≤ 0.05; y 4. Finalmente, no fue posible el contraste de las prevalencias observadas de la especie Aeromonas hydrophila en los alimentos marinos CCCC de las cuatro áreas geográficas debido a que no cumple con las recomendaciones formuladas por Cochran (44).
CONCLUSIONES
1. Los alimentos marinos C, MSC, PCCC y CCCC representan factores potenciales de riesgo por la especie Aeromonas hydrophila para el desarrollo de GA, IH, IU, SP y SS para la población consumidora de peces y/o mariscos de Puerto Ángel, Oaxaca, México.
2. El hallazgo de alimentos marinos CCCC contaminados con la especie Aeromonas hydrophila, una de las tres especies de importancia clínica del género Aeromonas, permite suponer la existencia de manipuladores de alimentos marinos portadores asintomáticos.
3. Lo anterior debe ocupar la atención de las autoridades sanitarias con el objeto de continuar con la realización de estudios relacionados a este respecto. Asimismo, si hasta la fecha no ha sido considerado como un problema de salud pública es conveniente tenerlo presente con el objeto de prevenir problemas sanitarios que pudieren en algún momento repercutir en la salud de la población consumidora de peces y/o mariscos de Puerto Ángel, Oaxaca, México.
RECOMENDACIONES
1. La elaboración de un programa de educación para la salud con el objetivo de fomentar en la población de Puerto Ángel, Oaxaca, México, el desarrollo de actitudes y conductas que le permitan participar en la prevención de enfermedades individuales y colectivas para protegerse de esta manera de los riesgos que pongan en peligro su salud.
2. La ejecución de un control sanitario integral de establecimientos (coctelerías, pescaderías y restaurantes) que expenden alimentos marinos para consumo humano.
3. La continuación de estudios relacionados con la especie Aeromonas hydrophila.
4. Continuar la presente investigación con un estudio que tenga como objetivo la búsqueda de la especie Aeromonas hydrophila tanto en las heces fecales como en los sueros de los manipuladores de alimentos marinos de las coctelerías, las pescaderías y los restaurantes de Puerto Ángel, Oaxaca, México.
REFERENCIAS BIBLIOGRÁFICAS
1. García-Martos P, Benjumeda M, Delgado D. Otitis externa por Vibrio alginolyticus: descripción de cuatro casos 1993; Acta Otorrinolaringol Esp. 44(1): 55-57.
2. Garrity GM, Bell JA, Lilburn TG. Taxonomic Outline of the Prokaryotes. Bergey's Manual of Systematic Bacteriology. Second Edition. Release 5.0; 2004. p. 112-3.
3. Giono CS. Agentes bacterianos de infecciones gastrointestinales, en: Giono CS, Escobar GA y Valdespino GJ, eds. Diagnóstico de Laboratorio de Infecciones Gastrointestinales. México D.F.: Secretaría de Salud. 1994. p.175-9.
4. Sistema Nacional de Vigilancia Epidemiológica. México D.F.: Secretaría de Salud. 2001: 18, Semana 52.
5. Janda JM. Recent advances in the study of the taxonomy, pathogenicity and infectious syndromes associated with the genus Aeromonas. Clin Microbiol Rev 1991;4:397-410.
6. Janda JM, Abbott SL. Evolving concepts regarding the genus Aeromonas an expanding panorama of species, diseases presentation, and unanswered questions. J Clin Infec Dis 1998;17: 332-44.
7. Rebollo B, Escamilla AE. Aislamiento e identificación de Aeromonas spp. y Plesiomonas shigelloides como causa de diarrea en humanos. INNSZ. Memorias Congreso Nacional Mexicano. Veracruz. 1984.
8. Martínez SP. Caracterización de cepas de Aeromonas aisladas de pacientes con síntomas de origen infeccioso en el Distrito Federal. Tesis de Licenciatura. Universidad Autónoma de Chiapas. México. 1996.
9. Franco-Monsreal J, Flores-Abuxapqui JJ, Suárez-Hoil GJ, Puc-Franco MA, Heredia-Navarrete MR, Vivas-Rosel ML. Prevalencia de Aeromonas hydrophila en alimentos marinos de origen animal de restaurantes de la ciudad de Mérida, Yucatán, México. 1999; Higiene. 1(3): 144-54.
10. Pavia AT, Bryan JA, Maher KL, Hester TR Jr., Farmer JJ III. Vibrio carchariae infection after a shark bite. 1989; Ann Intern Med. 111(1): 85-6.
11. Franco-Monsreal J, Flores-Abuxapqui JJ, Salas-Escajeda RM, Concha-Valdez FG, Puc-Franco MA, Heredia-Navarrete MR, Vivas-Rosel ML y Piña-Quijano JA. Aeromonas hydrophila, Vibrio alginolyticus y Vibrio fluvialis biovariedad II en alimentos marinos de origen animal de restaurantes de la ciudad y puerto de Progreso de Castro, Yucatán, México. 2008; Ciencia en la Frontera. 6(Número Especial): 45-57.
12. Franco-Monsreal J, Zarza-García AL, Villa-Ruano N, Ramón-Canul LG, Pacheco-Hernández Y, Cardeña-Bozziere IM, Mota-Magaña L. Aeromonas hydrophila en alimentos marinos de origen animal de coctelerías, cooperativa, pescaderías, restaurantes y supermercados de Isla del Carmen, Campeche, México. 2011; RedNutrición. 2(6): 13-8.
13. Disponible en: https://www.google.com.mx/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1920&bih=911&q=puerto+%C3%A1ngel+oaxaca&oq=puerto+%C3%81ngel&gs_l=img.1.1.0l2.4593.11302.0.15085.12.12.0.0.0.0.661.1451.2-1j5-2.3.0....0...1ac.1.64.img..9.3.1449.z3qyx9_nBKI
14. Gobat P, Jemmi T. Comparison of seven selective media for the isolation of mesophilic Aeromonas species in fish and meat. Int J Food Microbiol 1995;24:375-84.
15. Janda JM. Aeromonas and Plesiomonas, in: Sussman M, ed. Molecular Medical Microbiology. San Diego: Academic Press; 2001. p. 1237-70.
16. Altwegg M. Aeromonas and Plesiomonas, in: Murray PR, Baron EJ, Pfaller MA, Tenover FC, eds. Manual of Clinical Microbiology. Washington: ASM press; 1999. p. 507-16.
17. Martínez MJ, Simon-Pujol D, Congregado F. The presence of capsular polysaccharide in mesophilic Aeromonas hydrophila serotypes O:11 and O:34. FEMS Microbiol Lett 1995;128:69-73.
18. Kokka RP, Janda JM, Oshiro LS, Altwegg M, Shimada T, Sakazaki R et al. Biochemical and genetic characterization of autoagglutinating phenotypes of Aeromonas species associated with invasive and noninvasive disease. J Infect Dis 1991;163:890-4.
19. Dooley JSG, McCubbin WD, Kay CM, Trust TJ. Isolation and biochemical characterization of the S-layer protein from a pathogenic Aeromonas hydrophila strain. J Bacteriol 1988;170:2631-8.
20. Kokka RP, Velki AM, Clark RB, Bottone EJ, Janda J. Immune response to S layer-positive O:11 Aeromonas associated with intestinal and extraintestinal infections. Immunol Infect Dis 1992;2:111-4.
21. Dooley JSG, Lallier R, Shaw DH, Trust TJ. Electrophoretic and immunochemical analyses of the lipopolysaccharides from various strains of Aeromonas hydrophila. J Bacteriol 1985;164:263-9.
22. Ho Asy, Sohel I, Schoolnik GK. Cloning and characterization of fxp, the flexible pilin gene of Aeromonas hydrophila. Mol Microbiol 1992;6:2725-32.
23. Kirov SM, Sanderson K. Characterization of a type IV bundleforming pilus (SFP) from a gastroenteritis-associated strain of Aeromonas veronii bv sobria. Microb Pathog 1996;21:23-34.
24. Pepe CM, Eklund MW, Strom MS. Cloning of an Aeromonas hydrophila type IV pilus biogenesis gene cluster: complementation of pilus assembly functions and characterization of a type IV leader peptidase/N-methyltransferase required for extracellular protein secretion. Mol Microbio 1996;19: 8578-91.
25. Jeanteur D, Gletsu N, Pattus F, Buckley JT. Purification of Aeromonas hydrophila major outer-membrane proteins: N-terminal sequence analysis and channel-forming properties. Mol Microbiol 1992;6:3355-63.
26. Pemberton JM, Kidd SP, Schmidt R. Secreted enzymes of Aeromonas. FEMS Microbiol Lett 1997;152:1-10.
27. Buckley JT, Howard SP. The cytotoxic enterotoxin of Aeromonas hydrophila is aerolysin. Infect Immun 1999;67:466-7.
28. Bernheimer AW, Avigad LS. Partial characterization of aerolysin, a lytic exotoxin from Aeromonas hydrophila. Infect Immun 1974;9:1016-21.
29. Howard SP, Garland WJ, Green MJ, Buckley JT. Nucleotide sequence of the gene for the hole-forming toxin aerolysin of Aeromonas hydrophila. J Bacteriol 1987;169:2869-71.
30. Buckley JT. The channel – forming toxin aerolysin. FEMS Microbiol Immunol 1992;5:13-7.
31. Chopra AK, Houston CW. Enterotoxins in Aeromonas-associated gastroenteritis. Microbes Infect 1999;1:1129-37.
32. Albert JM, Ansaruzzaman M, Talukder KA, Chopra AK, Inger Kuhn, Rahman M et al. Prevalence of enterotoxin genes in Aeromonas spp. isolated from children with diarrhea, healthy controls, and the environment. J Clin Microbiol 2000;38: 3785-90.
33. Chopra AK, Xu XJ, Ribardo D, González M, Jul K, Peterson JM et al. The citotoxic enterotoxin of Aeromonas hydrophila induces proinflammatory cytokine production and activates arachidonic acid metabolism in macrophages. Infect Immun 2000;5:2808-18.
34. Rodríguez LA, Ellis AE, Nieto TP. Purification and characterization of an extracellular metalloprotease, serine protease and haemolysin of Aeromonas hydrophila strain B32: all are lethal for fish. Microb Pathog 1992;13:17-24.
35. Cascón A, Yugueros J, Temprano A, Sánchez M, Hernanz C, Luengo JM et al. A major secreted enastase is essential for pathogenicity of Aeromonas hydrophila. Infect Immun 2000;68:3233-41.
36. Merino S, Aguilar A, Nogueras MM, Regue M, Swift S, Tomás JM. Cloning, sequencing and role in virulence of two phospholipases (A1 and C) from mesophilic Aeromonas sp. serogroup 0:34. Infect Immun 1999;67:4008-13.
37. Anguita J, Rodriguez-Aparicio LB, Navarro G. Purification, gene cloning, amino acid sequence analysis, and expression of an extracellular lipase from an Aeromonas hydrophila human isolate. Appl Environ Microbiol 1993;59:2411-7.
38. Brumlik MJ, Buckley JT. Identification of the catalytic triad of lipase/acyltransferase from Aeromonas hydrophila. J Bacteriol 1996;178:2060-4.
39. Vipond R, Bricknell IR, Durant E, Bowden TJ, Ellis AE, Smith M et al. Defined deletion mutants demonstrate that the major secreted toxins are not essential for the virulence of Aeromonas salmonicida. Infect Immun 1998;66:1990-8.
40. Chang MC, Chang SY, Chen SL, Chuang SM. Cloning and expression in Escherichia coli of the gene encoding an extracellular deoxyribonuclease (DNase) from Aeromonas hydrophila. Gene 1992;122:175-180.
41. Barghouthi S, Young R, Olson MOJ, Arceneaux JE, Clem LW, Byers BR. Amonabactin, a novel tryptophan- or phenylalanine-containing phenolate siderophore in Aeromonas hydrophila. J Clin Microbiol 1989;171:1811-6.
42. Stintzi A, Barnes C, Xu J, Raymond KN. Microbial iron transport via a siderophore shuttle: a membrane ion transport paradigm. Proc Natl Acad Sci 2000;97:10691-6.
43. Pavan ME, Abbot SL, Zorzopulos J, Janda JM. Aeromonas salmonicida subs. pectinolytica subs. nov., a new pectina sepositive subspecies isolated from a heavily polluted river. Int J Syst Evol Microbiol 2000;3:1119-24.
44. Cochran, W.G. Some methods for strengthening the common x² tests. Biometrics 1954;10(4): 417-51.
45. Daniel, W.W. (2014). Bioestadística: base para el análisis de las ciencias de la salud. Cuarta edición. México, D.F.: Editorial Limusa. pp. 91-2, 143-4.
46. Peffers, A.S., Bailey, J., Barrow, G.I. & Gobbs, B.C. (1973). Vibrio parahaemolyticus gastroenteritis and international air travel. Lancet. 1(7795): 143-5.
47. Fujino, T.T. (1967). Report of the food hygiene sub-committee on Vibrio parahaemolyticus. In: Fujino, T. & Fukumi, H. (ed). Vibrio parahaemolyticus. Nayashoten: 673-725.
48. Pérez-Memije, E., Vélez-González, M.L. y Galván-Rodríguez, F. (1980). Búsqueda de Vibrio parahaemolyticus en heces de manejadores de alimentos en el puerto de Acapulco, Guerrero. Rev Lat-amer Microbiol. 22(1): 18.
49. Franco-Monsreal, J. y Flores-Abuxapqui, J.J. (1988). Prevalencia de Vibrio parahaemolyticus en productos marinos y en heces de manipuladores de alimentos. Rev Lat-amer Microbiol. 30: 223-7.
