METHOTREXATE-INDUCED SUBACUTE NEUROTOXICITY AND USE OF DEXTROMETHORPHAN. CASE REPORT
Jesús Ernesto Galeana-de-la-Rosa1,2, Alexis Cruz-Cardona3, Juan Martínez-Aguilar3, Laureano de Jesús Cupul-Flores3, Clarissa de Jesús Rodríguez-Rivero3
1 Hospital General de Chetumal. Secretaría de Salud de Quintana Roo. México.
2 División de Ciencias de la Salud. Universidad de Quintana Roo. México.
3 Estudiante de la División de Ciencias de la Salud. Universidad de Quintana Roo. México.
Correspondencia: Juan Martínez-Aguilar. Correo electrónico: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla..
Recibido: 18 de enero de 2018
Aceptado: 23 de febrero de 2018
RESUMEN
Introducción. El metotrexato (MTX) es una droga esencial en el tratamiento de la leucemia aguda linfoblástica (LAL). Al igual que el resto de fármacos, su uso no está exento de potenciales efectos adversos como la neurotoxicidad (NT). Además del riesgo inherente del medicamento, el uso concomitante de ciertas sustancias puede aumentar las concentraciones séricas del MTX, lo cual incrementa el riesgo de presentar NT. La disminución de los niveles de vitamina B12 es uno de los mecanismos implicados en el desarrollo de la NT. Se ha reportado en la literatura que el dextrometorfano (DXM) es un fármaco útil para revertir este efecto adverso. Caso clínico. Se reporta el caso de una paciente de 10 años de edad con LAL de alto riesgo, que presenta datos de NT subaguda por MTX dos semanas después de iniciar tratamiento de consolidación con altas dosis de MTX; ésta se revirtió con DXM en menos de 12 horas.
Conclusión. Se obtuvo una recuperación rápida del cuadro de NT por MTX tras la administración de DXM, concordando con lo reportado en la literatura. Por lo cual, el tratamiento con DXM se puede considerar como opción terapéutica para la NT subaguda por MTX. La NT por MTX es un padecimiento no tan raro en este grupo de pacientes, por lo que se espera que esta publicación colabore con la difusión de la NT y su tratamiento, además de dar pie a futuras investigaciones.
Palabras clave: Síndromes de Neurotoxicidad; Metotrexato; Dextrometorfano; Leucemia-Linfoma Linfoblástico de Células T Precursoras
ABSTRACT
Introduction. Methotrexate (MTX) is an essential drug in the treatment of acute lymphoblastic leukemia (ALLL). Like all other drugs, its use is not without potential adverse effects such as neurotoxicity (NT). In addition to the inherent risk of the drug, concomitant use of certain substances may increase serum MTX concentrations, which increases the risk of developing NT. Reducing vitamin B12 levels is one of the mechanisms involved in NT development. It has been reported in the literature that dextromethorphan (DXM) is a useful drug for reversing this adverse effect.
Clinical case: We report a case of a 10-year-old female with high risk ALL who presents subacute MTX NT data two weeks after receiving high dose MTX consolidation therapy; NT was reversed within 12 hours of initiating DXM.
Conclusion. A quick retrieval of the NT frame by MTX was obtained after the administration of DXM, as reported in literature. Therefore, DXM treatment can be considered as a therapeutic option for subacute NT by MTX. MTX NT is a rare condition in this group of patients, so this publication is expected to contribute to the spread of NT and its treatment, as well as to lead to future research.
Key words: Neurotoxicity Syndromes; Methotrexate; Dextromethorphan; Precursor T-Cell Lymphoblastic Leukemia-Lymphoma
INTRODUCCIÓN
Una de las drogas quimioterápicas fundamentales en el tratamiento de la leucemia aguda linfoblástica es el metotrexato (MTX). Este inhibe la dihidrofolato reductasa, impidiendo el paso de dihidrofolato a tetrahidrofolato, lo cual minimiza la proliferación celular por disminución de 5-metil-tetrahidrofolato. Sin embargo, como cualquier fármaco, el MTX puede producir ciertos efectos adversos, uno de ellos es la neurotoxicidad (NT)(1). Se ha reportado una prevalencia de NT de 3,1% en pacientes que siguen un esquema de quimioterapia que incluye MTX en altas dosis o MTX intratecal (2).
De igual manera, se han descrito distintos mecanismos que intentan explicar la neurotoxicidad asociada a la administración de metotrexato (Figura 1), entre estos se encuentran los siguientes:
· Alteración de la mielinización de los nervios periféricos: existe una asociación de las discapacidades motoras y sensoriales con la mielinización del nervio periférico (3). La mielinización del nervio periférico es uno de los roles más importantes que desempeña la metilación del ADN. La 5-metil-tetrahidrofolato es esencial para el paso de homocisteína a metionina, a través de la cual se produce S-adenosil-metionina (SAM), implicada en la metilación del ADN llevada a cabo por la enzima ADN metiltransferasa (DNMT) (4).
· Disminución de vitamina B12 asociado a una consecuente disminución de la metilación del ADN: la vitamina B12 es utilizada como cofactor para el paso de homocisteína a metionina, importante para la metilación del ADN por mecanismos antes descritos (3).
· Uso de otros medicamentos: la administración de algunos medicamentos durante el tratamiento con MTX puede incrementar sus concentraciones, al igual que puede disminuir los niveles de vitamina B12. El uso de fluoroquinolonas y piperacilina puede causar el primer efecto y la administración de óxido nitroso como sedante durante la administración de MTX intratecal, el segundo (5).
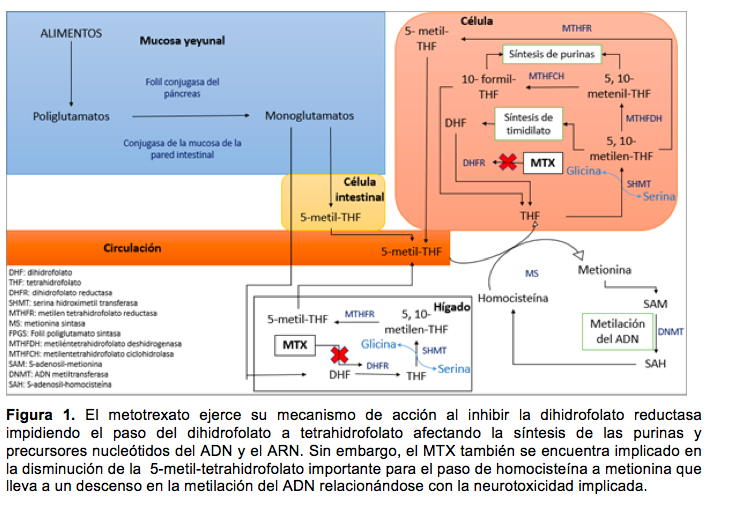
Existen fármacos como el folinato de calcio (leucovorin) que por su mecanismo de acción, funcionan como “antídoto” para la intoxicación por metotrexato. Este, en particular, compite activamente con el MTX en los sitios de transporte, lo desplaza de los sitios de unión intracelular y restaura las reservas de folato necesarias para la síntesis de ADN / ARN. Por otro lado, el dextrometorfano (DXM), parece evitar o revertir la neurotoxicidad por MTX al ser un antagonista de los receptores de N-metil-D-aspartato, impidiendo así la unión de la homocisteína y sus metabolitos a dicho receptor (6).
La neurotoxicidad por MTX se puede dividir en: aguda, – dentro de las primeras 48 horas-; subaguda, -de 48 horas a semanas- y crónica, -de meses a años-; luego de la administración del fármaco (2). La forma aguda se presenta con somnolencia, astenia, desorientación, convulsiones y aracnoiditis química. En la subaguda se manifiesta una encefalopatía llamada “síndrome de apoplejía”, debido a que se caracteriza por hemiparesia, ataxia, afasia, convulsiones, confusión y alteraciones afectivas. La administración intratecal de MTX se ha asociado a mielopatía severa seguida de dolor de miembros inferiores, cambios sensoriales, paraplejia y disfunción de la vejiga. Las manifestaciones crónicas pueden incluir discapacidad de aprendizaje y alteraciones cognitivas (7). La resonancia magnética (RM) y la tomografía computarizada (TC) pueden demostrar anormalidades transitorias de la materia blanca en casos agudos y subagudos. En los casos crónicos puede haber leucoencefalopatía, que se muestra como daño difuso en la materia blanca, atrofia cortical, agrandamiento ventricular, áreas de calcificación puntiformes dentro de los ganglios basales y la masa blanca profunda (8).
A pesar del amplio conocimiento en cuanto a la fisiopatología de la LAL y la farmacología del MTX, actualmente no existe información suficiente respecto al tratamiento de la NT por MTX. Es por ello que el objetivo de la presente publicación es dar a conocer este efecto adverso y los resultados que se obtienen al utilizar el DXM para revertirlo.
REPORTE DE CASO
Femenino de 10 años de edad portadora de leucemia aguda linfoblástica de precursores B de alto riesgo por edad, cuyos padres dieron consentimiento informado sobre el tratamiento del padecimiento de base y sus complicaciones, así como para la publicación de su información médica sin hacer mención de datos personales. Se presentó al diagnóstico el 22 de diciembre de 2016 con hemoglobina 8.2 g/dl, plaquetas 8,000/µL, leucocitos 3,600/µL, linfocitos 72%, aspirado de médula ósea con 100% de blastos de estirpe linfoide, inmunofenotipo CD19+, CD79a+, CD34+, CD38+ tenue, CD45+ tenue, CD10 heterogénea, CD20-, HLA-DR +, IgS-, TdT-, cadenas Mu citoplasmáticas negativo, compatible con leucemia aguda linfoide de precursores B (B-II temprana o común).
La paciente inició tratamiento para leucemia aguda linfoblástica de alto riesgo para recaída con base en protocolo del Seguro Popular (basado en Total XIIIB de St. Jude) el 30 de diciembre de 2016. El 27 de enero de 2017 completó quimioterapia de inducción a la remisión con 0% de blastos en aspirado de médula ósea. Inició quimioterapia de consolidación el 14 de febrero de 2017, recibió quimioterapia de reinducción del 14 de julio al 04 de agosto de 2017, sin eventualidades.
El 22 de agosto de 2017 inició segunda consolidación con altas dosis de MTX 3gr/m²/día IV en infusión de 24 horas, 6-mercaptopurina (75mg/m²/día VO x 7 días), ácido folínico 15mg/m²/dosis IV cada 3 horas por 10 dosis y triple quimioterapia intratecal MTX (12 mg), hidrocortisona (24 mg) y citarabina (36 mg), sin complicaciones. Seis días después presentó temblor fino en ambas extremidades superiores que cedían a la sujeción, así como arreflexia osteotendinosa (reflejos braquial, radial y rotuliano) que fueron asociados con probable neurotoxicidad por vincristina administrada en la fase de reinducción.
El 29 de agosto de 2017 recibió segundo ciclo de altas dosis de MXT 3gr/m²/día IV en infusión de 24 horas, 6-mercaptopurina 75mg/m²/día VO x 7 días), ácido folínico 15mg/m²/dosis IV cada 3 horas por 10 dosis y triple quimioterapia intratecal (MTX 12 mg, hidrocortisona 24 mg y citarabina 36 mg). Veinticuatro horas después, la paciente refirió náuseas, cefalea y dolor de extremidades, siendo manejada con ibuprofeno y ondansetrón. Tres días después del inicio de la quimioterapia manifestó dolor en cadera derecha, con aparición de dos picos febriles de 38 °C y evacuaciones diarreicas, por lo que se solicitó examen general de orina, urocultivo, coprocultivo y electrolitos séricos, los cuales no mostraron alteraciones.
Se inició tratamiento antibacteriano empírico con ceftriaxona y amikacina. Al quinto día de inicio de quimioterapia presentó episodio de temblor sin pérdida del estado de alerta, el cual cedió espontáneamente. Siete días después del inicio del metotrexato presentó un episodio de agitación psicomotriz con clonus del hemicuerpo derecho, sin deterioro del estado de alerta, por lo que se solicitó tomografía computarizada simple y contrastada de cráneo, para descartar lesión estructural orgánica, así como glucosa y electrolitos séricos en búsqueda de alteración metabólica. Los resultados de dichos estudios se encontraron sin alteraciones. Horas más tarde la paciente evolucionó con hemiparesia izquierda, signo de Babinsky positivo bilateral y parálisis facial central izquierda con disfagia y disartria.
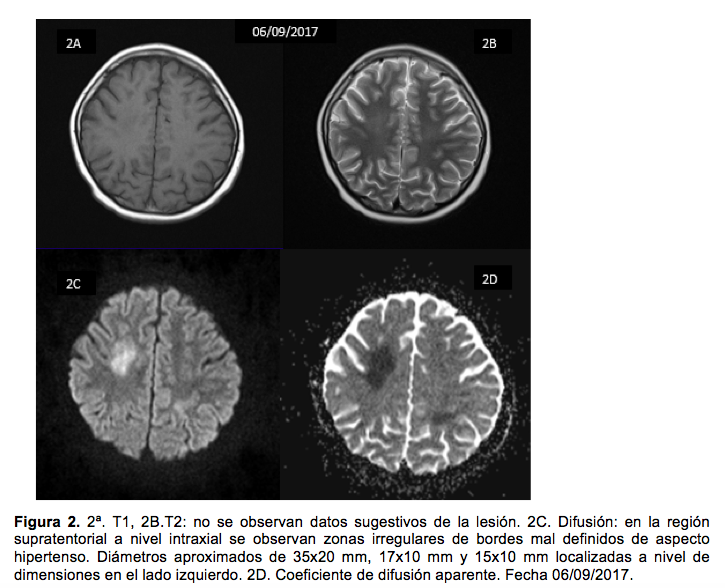
Al octavo día se realizó resonancia magnética de cráneo (figura 2), cuyos hallazgos, sumados a la clínica, sugirieron neurotoxicidad subaguda por altas dosis de MTX. Se comentó con los padres sobre los riesgos y los beneficios del tratamiento con DXM para este tipo de neurointoxicación, quienes aceptaron el uso del fármaco. Por lo tanto, se inició tratamiento con DXM (3 mg/kg/día IV dividido en dos dosis), difenilhidantoína (10 mg/kg/d IV dividido en tres dosis) y ácido acetilsalicílico (100 mg/día VO en una vez cada 24 horas).
Se encontró respuesta favorable en menos de 12 horas con mejoría de la disartria, la disfagia y aumento de movimientos activos de las cuatro extremidades con discreta disminución de la fuerza del hemicuerpo izquierdo, sin presencia de crisis de agitación psicomotriz; se suspendió difenilhidantoína y continuó tratamiento con dextrometorfano 3 mg/kg/día vía oral dividido cada 8 horas. Se identificó biometría hemática con hemoglobina de 8.3 g/dL, por lo que se decidió transfundir una unidad de concentrados eritrocitarios para mejorar oxigenación al sistema nervioso central.
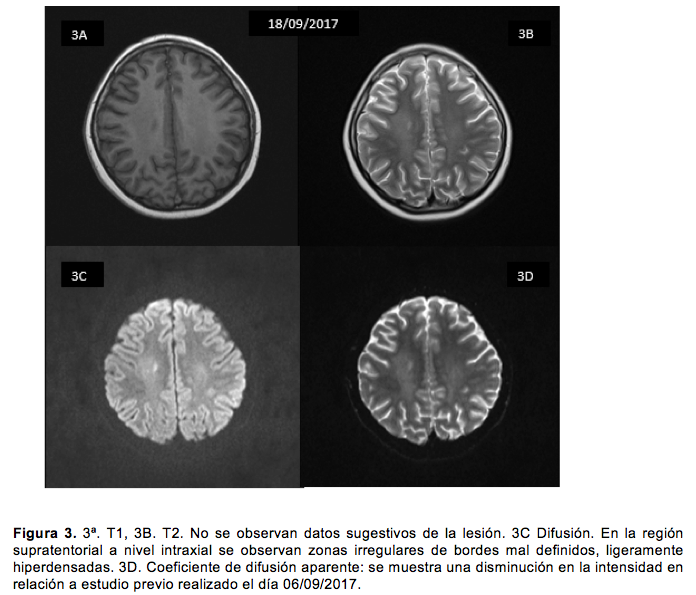
Al vigésimo día se pidió resonancia magnética de control, que mostró mejoría en comparación a los hallazgos de la primera (figura 3).
DISCUSIÓN
El MTX es uno de los fármacos fundamentales en el tratamiento de diversas patologías, entre las que se encuentra la LAL. A pesar de no conocer de forma exacta cuál es el mecanismo, sí se sabe que uno de los efectos adversos del MTX es la NT; ya sea aguda, subaguda o crónica. El uso de dextrometorfano ha mostrado buenos resultados en pacientes con NT subaguda por metotrexato, con un promedio de inicio de respuesta de 13.9 horas; con un rango de 0.2 a 43 horas (9).
En este reporte de caso, la paciente tuvo un inicio de respuesta menor de 12 horas, lo cual coincide con lo previamente reportado en la literatura. Sin embargo, se ha visto casos en los cuales la neurointoxicación ha remitido de manera espontánea, únicamente utilizando medidas de sostén; pero también se ha reportado aumento de la mortalidad de esta manera (10). A pesar del inicio rápido de resolución del efecto adverso y el fácil acceso al DXM en la mayoría de los hospitales en México, se necesita realizar más estudios con poblaciones mayores para poder considerarse como medicamento de primera elección.
CONCLUSIÓN
La NT por MTX es un padecimiento no tan raro en este grupo poblacional. Sin embargo, hay escasa información reportada en la literatura con respecto al tratamiento, a pesar de que clínicamente puede ser reversible en su totalidad con el manejo adecuado. Por lo tanto, se espera que esta publicación contribuya a la difusión de su tratamiento y dé pie a futuras investigaciones con grupos poblacionales mayores.
Agradecimientos:
Agradecemos al Mtro. Armando Alberto León López por su orientación metodológica y revisiones otorgadas en la redacción de este trabajo.
REFERENCIAS
1. Bhojwani D, Sabin ND, Pei D, Yang JJ, Khan RB, Panetta Jc, et al.Methotrexate-induced neurotoxicity and leukoencephalopathy in childhood acute lymphoblastic leukemia. Journal of Clinical Oncology. 2014; 32 (9): 949-959.
2. Vezmar S, Becker A, Bode U, Jaehde U. Biochemical and clinical aspects of methotrexate neurotoxicity. Chemotherapy. 2003; 49(1-2): p. 92-104.
3. Milman N. Intestinal absorption of folic acid- new physiologic & molecular aspects. Indian J Med Res. 2012; 136(5): p. 725-728.
4. Forster J, Van Delft FW, Baird SF, Mair S, Skinner R, Halsey C. Drug interactions may be important risk factors for methotrexate neurotoxity, particularly in pediatric leukemia patients. Cancer Chemotherapy and Pharmacology. 2016; 78(5): p. 1093-1096.
5. Drachtman RA, Golden CB, James J, Aisner J. Dextromethorphan is effective in the treatment of subacute methotrexate neurotoxicity. Pediatric Hematology and Oncology. 2002; 19(5):319-27.
6. García-Puig OCM, Fons-Estupiña, MC, Rives-Solà S, Berrueco-Moreno R, Cruz-Martínez O, Campistol J. Neurotoxicidad por metotrexato en pacientes pediátricos. Descripción de los síntomas clínicos y hallazgos neurorradiológicos. Rev Neurol. 2012; 54(12): p. 712-718.
7.Newton HB. Neurological complications of chemotherapy to the central nervous system. Handb Clin Neurol. 2012; 105.
8. Forster VJ, McDonnell A, Theobald R, McKay JA. Effect of methotrexate/vitamin B12 on DNA methylation as a potential factor in leukemia treatment-related neurotoxicity. Epigenomics. 2017; 9(9): p. 1-14.
9. Afshar M, Birnbaum D, Golden C. Review of dextromethorphan administration in 18 patients with subacute methotrexate central nervous system toxicity. Pediatric Neurology. 2014; 50: p. 625-629.
10. Coker A, Pastel DA, Davis MC, Bengtson M, Fadul CE, Lewis LD. Methotrexate encephalopathy: Two cases in adult cancer patients, who recovered with pathophysiologically based therapy. SAGE Open Medical Case Reports. 2017; 5: p. 1-4.





