BACTERIAL RESISTANCE IN URINE CULTURES IN A QUINTANA ROO HOSPITAL FOR A PERIOD OF EIGHT MONTHS
Luis Ángel Mora-Hernández1, Guillermo Padrón-Arredondo2
1 Médico interno de pregrado. Hospital General de Playa del Carmen. Servicios Estatales de Salud de Quintana Roo. México.
2 Hospital General de Playa del Carmen. Servicios Estatales de Salud de Quintana Roo. México.
Correspondencia: Guillermo Padrón-Arredondo. Correo electrónico: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
Recibido: 08 de mayo de 2017.
Aceptado: 26 de septiembre de 2017.
RESUMEN.
Introducción. El diagnóstico clínico de infección de las vías urinarias está sometido a muchos errores si los métodos de análisis no son los adecuados. En la atención primaria de salud, el análisis de orina microscópico debería estar disponible para poder realizar un buen diagnóstico acerca de la etiología subyacente.
Objetivo. Identificar la frecuencia de resistencia bacteriana en los urocultivos tomados a pacientes ingresados en el Hospital General de Playa del Carmen, Quintana Roo en el periodo de marzo a diciembre de 2016.
Materiales y método. Se realizó un estudio transversal para conocer la frecuencia de resistencia bacteriana en los urocultivos tomados a pacientes ingresados en el Hospital General Playa del Carmen, Quintana Roo. Se analizaron las variables de sexo, edad, factores de riesgo como gérmenes sensibles y resistentes, antibióticos sensibles y resistentes. Se utilizó estadística descriptiva.
Resultados. Durante el periodo de estudio se procesaron 437 urocultivos, 299 (68,4%) de consulta externa y 138 (31,6%) de hospitalización; 274 (63,0%) sin desarrollo bacteriano y 163 (37,0%) urocultivos con desarrollo bacteriano; el microorganismo aislado con mayor frecuencia fue E. Coli. La eritromicina fue el antibiótico con mayor número de bacterias resistentes (61,0%); los antibióticos con menor resistencia antimicrobiana fueron: imipenem 0%, seguido de tetraciclina 19,0% y amikacina con 21,0%.
Conclusión. La bacteria identificada con mayor frecuencia fue Escherichia coli, y la mayor resistencia bacteriana de ésta fue para cefalosporinas, ciprofloxacino y amoxicilina. Los antibióticos que presentaron mayor falla a bacterias resistentes fueron: eritromicina, ciprofloxacino y cefotaxima. Los fármacos nitrofurantoína, gentamicina, fosfomicina, piperacilina y amikacina siguen siendo muy efectivos.
Palabras clave: Sistema Urinario; Farmacorresistencia Bacteriana; Antibacterianos; Prueba en orina con bacterias revestidas con anticuerpos.
ABSTRACT
Introduction. The clinical diagnosis of urinary tract infection is subject to many errors if the methods of analysis are not adequate. In primary health care, microscopic urinalysis should be available to make a good diagnosis of the underlying etiology.
Objective. To Identify the frequency of bacterial resistance in urine cultures taken from patients admitted to the General Hospital of Playa del Carmen, Quintana Roo in the period from March to December 2016.
Materials and method. A cross-sectional study was carried out to determine the frequency of bacterial resistance in urine cultures taken from patients admitted to the General Hospital of Playa del Carmen, Quintana Roo. We analyzed the variables of sex, age, risk factors such as sensitive and resistant germs, sensitive and resistant antibiotics. Descriptive statistics were used.
Results. During the study period, 437 urine cultures were processed, 299 (68,4%) from outpatient clinics and 138 (31,6%) from hospitalization; 274 (63,0%) with no bacterial growth and 163 (37,0%) urine cultures with bacterial growth; the most frequently isolated microorganism was E. Coli. Erythromycin was the antibiotic with the highest number of resistant bacteria (61,0%); antibiotics with the lowest antimicrobial resistance were: imipenem 0%, followed by tetracycline 19,0% and amikacin with 21,0%.
Conclusion. The most frequently identified bacteria were Escherichia coli, and the highest bacterial resistance of this bacteria was for cephalosporins, ciprofloxacin and amoxicillin. Antibiotics that failed most resistant bacteria were erythromycin, ciprofloxacin and cefotaxime. The drugs nitrofurantoin, gentamicin, phosphomycin, piperaciline and amikacin remain very effective.
Key words: Urinary System; Pharmacoresistence Bacterial; Antibacterials; Urine test with bacteria coated with antibodies.
INTRODUCCIÓN
La resistencia bacteriana a los antibióticos ha sido ampliamente documentada desde la misma aparición de estos medicamentos, de hecho, el abuso en la prescripción de antibióticos de “última generación” es una costumbre en la práctica médica; sin embargo, los estudios acerca de dicha resistencia no han sido realizados en los distintos medios en donde se aplican estos tratamientos y cada medio ambiente es distinto, así como su biótica. El diagnóstico clínico de infección de las vías urinarias (IVU) está sometido a muchos errores si los métodos de análisis no son adecuados; en la atención primaria de salud, el análisis de orina microscópico debería estar disponible para poder realizar un buen diagnóstico acerca de la etiología subyacente (1).
Cotidianamente, el manejo de una IVU es sintomático con la indicación de antibióticos, sin realizar urocultivo ni antibiograma. Del mismo modo, la obtención de la muestra para análisis se indica que deberá ser la primera orina matutina y tomada del chorro medio, lo cual es poco preciso y llega a mal diagnosticar él o los agentes causales de la infección. (1)
La experiencia ha demostrado que el cultivo en medio por inmersión está frecuentemente colonizado por más de una bacteria, como resultado de una contaminación secundaria. Está establecido que posterior a una limpieza adecuada de los genitales externos, las bacterias pueden ser identificadas en la toma de la muestra de orina en chorro medio, utilizando una prueba de dipstick y se puede iniciar el tratamiento correspondiente si se encuentra bacteriuria significativa (> 100.000 gérmenes patógenos/ml de orina). La concentración de 10.000 gérmenes patógenos requiere de exámenes de control y aún 1.000 gérmenes patógenos pueden indicar una IVU en isostenuria, pero en caso de duda, el cateterismo puede precisar el diagnóstico. Es de recordar que aún la ausencia de nitritos no excluye la presencia de una IVU (1).
Por otra parte, la disuria por sí misma no es diagnóstica de IVU, principalmente en las mujeres, ya que ésta puede indicar: vulvitis, dermatitis de la uretra distal, daño en la piel debido a aseo exagerado del área, o herpes genital recurrente. La vulva, la flora vaginal y el número de leucocitos en las secreciones vaginales, también son contaminantes de la orina, sin olvidar que el aseo insuficiente del área perianal, fuente de infección bacteriana, también es causa de IVU. (2)
En el Hospital General de Playa del Carmen no se tienen antecedentes de algún estudio para conocer el comportamiento de las bacterias y su resistencia a los antibióticos en general. Por ello, se decidió realizar este estudio para identificar la frecuencia de resistencia bacteriana en los urocultivos tomados a pacientes ingresados en dicho hospital, a fin de tener una base de comparación en futuros estudios similares.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional y transversal con el propósito de conocer la frecuencia de resistencia bacteriana en los urocultivos tomados a pacientes de consulta externa e ingresados en el Hospital General Playa del Carmen. El periodo de estudio fue del 12 de marzo al 21 de noviembre de 2016; se analizaron los resultados de los urocultivos tomados durante ese periodo.
Se incluyeron todos los urocultivos realizados en el periodo de estudio. Las variables estudiadas fueron: sexo, grupos de edad, factores de riesgo como gérmenes sensibles, gérmenes resistentes, antibióticos sensibles y antibióticos resistentes. Los medios utilizados para los cultivos fueron: sal y manitol; Agar sangre; agar MacConkey y agar Biggy. Se utilizó estadística descriptiva.
RESULTADOS
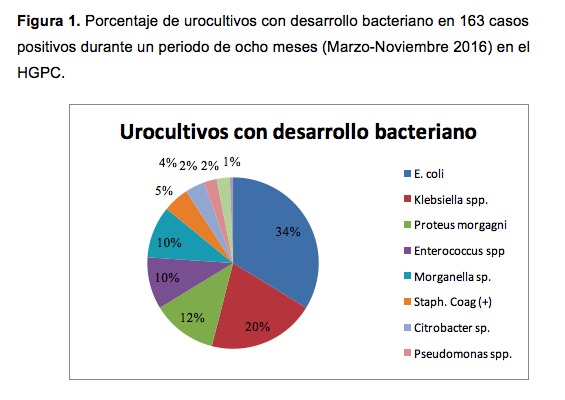
Se procesaron un total de 437 urocultivos, de los cuales 299 (68,4%) provenían de consulta externa y 138 (31,6%) de hospitalización; se identificaron 274 (63,0%) urocultivos sin desarrollo bacteriano y 163 (37%) urocultivos con desarrollo bacteriano; E. coli fue el microorganismo aislado con mayor frecuencia (34,0%) (figura 1).
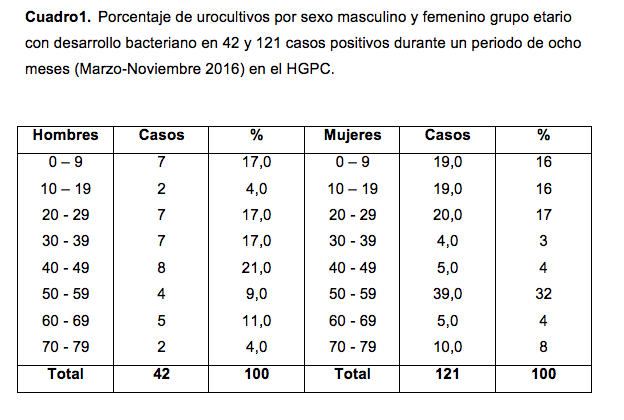
De total de casos en hombres (n=42), la mayor prevalencia de desarrollo bacteriano se presentó durante la quinta década de la vida 21,0% (n=8), y el grupo etario de la segunda y octava década de la vida fueron los que menor prevalencia de desarrollo bacteriano presentaron con 4,0% (n=2) cada uno.
Del grupo de mujeres (121 casos), la mayor prevalencia de desarrollo bacteriano se dio en la sexta década de la vida con 32,0% (n= 39) y la menor prevalencia fue en la cuarta década de la vida con 3,0% (n=4). Ver cuadro 1.
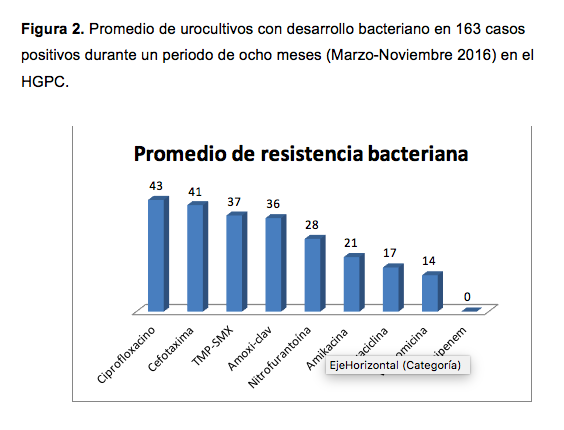
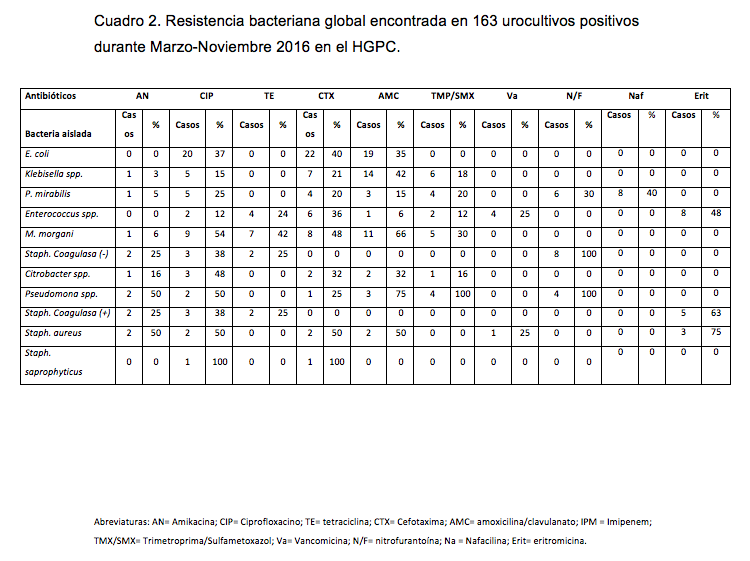
En cuanto a la resistencia bacteriana, los gérmenes presentaron mayor resistencia a ciprofloxacino y cefotaxima (ver figura 2), y al calcular la media, se obtuvo que eritromicina fue el antibiótico con mayor número de bacterias resistentes (61,0%), seguido de ciprofloxacino (43,0%), cefotaxima (41,0%), trimetroprima con sulfametoxazol (37,0%) y amoxicilina con ácido clavulánico (36,0%). Los antibióticos con menor resistencia antimicrobiana fueron: imipenem (0%), seguido de tetraciclina 19,0% y amikacina con 21,0%. La resistencia bacteriana global encontrada en este estudio se presenta en el cuadro 2.
DISCUSIÓN
Independientemente de las bacterias, el antibiótico que presentó mayor resistencia bacteriana fue el co-trimoxazol (27,0%) seguido de la ofloxacina. Las resistencias de E. coli al co-trimoxazol, ofloxacina, cefixima, nitrofurantoína y fosfomicina fueron, 26, 17, 6, 2 y 1%, respectivamente. Los factores de riesgo independientes para la resistencia a la ofloxacina de E. coli fueron edad mayor a 85 años y un historial de IVU en los últimos 6 meses. Estos hallazgos apoyan las pautas que recomiendan el ahorro de fluoroquinolonas. La poca resistencia de la E. coli a la fosfomicina justifica su uso como tratamiento de primera línea en la cistitis aguda.
En el presente estudio, el antibiótico con mayor resistencia fue el ciprofloxacino, no coincidiendo con los resultados de Malmartel (3), y con respecto a la fosfomicina, este antibiótico no se utiliza en nuestro medio ni formó parte del análisis del antibiograma de las IVU en el hospital donde se llevó a cabo la investigación.
Como en otros estudios, en esta investigación se identificaron más mujeres afectadas por este tipo de infecciones en relación con los hombres.
Malmartel A, et al., (3) enfatizan que los médicos generales a menudo tienen que manejar las IVU con tratamientos probabilísticos, aunque las resistencias bacterianas están aumentando. Ellos encontraron un análisis de orina positivo en 1119 pacientes, correspondiente a 1125 aislamientos bacterianos. Las especies bacterianas encontradas fueron: E. coli (73,0%), Enterococcus spp. (7,0%), Klebsiella spp. (6,0%), Proteus spp. (4,0%), Staphylococcus spp. (3,0%) y Pseudomonas spp. (2,0%). Los mismos resultados se encontraron en este estudio en cuanto a E. col;, sin embargo, Klebsiella spp., ocupó el segundo lugar y no el Enterococcus spp.
Van der Meeren BT, et al., (4) realizaron un estudio prospectivo de vigilancia para investigar la epidemiología y los patrones de resistencia a antibióticos entre uropatógenos de niños hospitalizados y realizaron la identificación de especies bacterianas, pruebas de susceptibilidad antimicrobiana y pruebas de β-lactamasa de espectro extendido para aislados bacterianos relevantes. Encontraron una prevalencia extremadamente alta de microorganismos altamente resistentes entre uropatógenos de niños hospitalizados con una infección del tracto urinario. En esta investigación, se encontró que los niños y las niñas tuvieron un porcentaje similar (17,0% vs. 16,0%) de urocultivos positivos.
Del mismo modo, Mbanga J, et al. (5), encontraron una prevalencia de resistencia a antibióticos en bacterias aisladas de pacientes con sospecha de infección urinaria durante un período de un año; 257 muestras de orina fueron analizadas para bacterias por procedimientos estándar. Las bacterias aisladas fueron E. coli (40,0%), Staphylococcus coagulasa negativo (16,0%), Klebsiella spp. (11,0%), Staph. aureus (8,0%), Streptococcus grupo B (8,0%) y Klebsiella oxytoca (8,0%). Se reveló una alta resistencia a ampicilina (85,0%) y co-trimoxazol (69,0%) entre los bacilos Gram negativos. Los cocos Gram positivos mostraron resistencia al ácido nalidíxico (81,0%) y co-trimoxazol (69,0%). E. coli fue susceptible a la mayoría de los fármacos, pero 84,0% de las cepas eran resistentes a la ampicilina y 68,0% al co-trimoxazol. Todos los aislamientos fueron sensibles a Nicene (nitroxalina, sulfametizol, piridoxina), fármaco que no se comercializa en el sector salud de México.
Por otra parte, la resistencia a los antibióticos también es un problema en los asilos de ancianos. Fagan M, et al., (6) en su estudio examinaron los resultados de cultivo de orina de pacientes de edad avanzada. Recolectaron 232 cultivos de orina positivos en un grupo (asilo) y 3.554 cultivos en el grupo comunitario. E. coli fue aislado en 145 orinas en el grupo de asilo (64,0%) y 2.275 (64,0%) en el grupo comunitario. No hubo diferencias clínicamente significativas en la resistencia. Hubo 3.016 cultivos de orina positivos de mujeres y 770 de hombres. E. coli fue significativamente más común en las mujeres 2.120 (70,0%) que en los hombres 303 (39,0%). Enterococcus faecalis fue significativamente menos frecuente en mujeres 223 (7%) que en los hombres 137 (18%). Para las mujeres, hubo menores tasas de resistencia al ciprofloxacino para E. coli (7,0% vs 12,0%), y mecillinam para Proteus mirabilis (3,0% vs 12,0%). Concluyeron que las diferencias en las tasas de resistencia de los pacientes en el hogar de ancianos, no garantizan recomendaciones para la terapia antibiótica empírica, pero las recomendaciones basadas en el género parecen justificadas. El presente estudio reveló que el porcentaje entre hombres y mujeres con urocultivos positivos fue similar (15,0% hombres y 12,0% mujeres) en población abierta.
Hines MC, et al. (7), enfatizan que los cultivos de orina no siempre se realizan para pacientes de los departamentos de Urgencias. Por consiguiente, los antibiogramas hospitalarios, e incluso específicos de los departamentos de urgencias, podrían estar sesgados hacia pacientes ancianos con muchas comorbilidades y tasas relativamente altas de resistencia antimicrobiana y, por lo mismo, no reflejan con precisión a las mujeres que de otro modo eran sanas. Estos autores concluyeron que los antibiogramas del departamento de urgencias pueden sobreestimar las tasas de resistencia a uropatógenos que causan IVU no complicadas. En los casos en los que no se puede utilizar nitrofurantoína, las fluoroquinolonas y, posiblemente, TMP-SMX pueden seguir siendo opciones viables para el tratamiento de la IVU no complicada y pielonefritis en mujeres. En el presente estudio no se obtuvieron muestras de cultivos del departamento de urgencias porque en ese servicio no se realizan ese tipo de análisis; sin embargo, el estudio de Hines, nos ofrece pautas para el manejo de estos pacientes en dicho servicio, mismo que podría implementarse en un futuro próximo.
En su estudio, Catal F et al. (8), encontraron que en los pacientes con sospecha de IVU, el tratamiento con antibióticos suele iniciarse empíricamente, antes de que los resultados del cultivo de orina estén disponibles, lo cual es correcto. Desafortunadamente, la resistencia a los antibióticos se ha convertido en un problema clínico cada vez más acuciante en muchos países. Por lo tanto, ellos realizaron un análisis retrospectivo de los datos de todas las muestras de orina pediátrica procesadas durante un período de seis años, y encontraron un total de 767 patógenos urinarios en 767 episodios de IVU en 698 pacientes. El agente causal más común fue E. coli, seguido por Klebsiella spp. Esto coincide con la bacteria encontrada en nuestro estudio.
Durante el año 2000, casi 60,0% de los aislamientos de E. coli eran susceptibles a la ampicilina (AMP), más del 40,0% al co-trimoxazol (SXT), más del 80,0% a la gentamicina (GN), más del 90,0% a la cefuroxima (CXM) y amikacina (AN), y más del 60,0% a piperacilina (PIP). En 2006, más del 70,0% eran resistentes a la AMP y más del 50,0% eran resistentes al PIP. En el año 2000, el CIP (3,0% de aislamientos resistentes) y CXM (3,0% de aislamientos resistentes) fueron los agentes más activos contra Klebsiella spp., y ninguno de los aislamientos resultó ser resistente al imipenem (IMP). Los autores de dicho estudio concluyeron que la selección empírica de antibióticos debe basarse en el conocimiento de la prevalencia local de organismos bacterianos y de las sensibilidades a los antibióticos, porque los patrones de resistencia pueden variar en diferentes regiones, siendo uno de los objetivos del presente trabajo.
En esta investigación, uno de los propósitos fue establecer una línea basal de la resistencia bacteriana a los antibióticos, con el fin de hacer comparaciones a futuro del comportamiento de esta resistencia. Por tradición, el manejo inicial de las IVU es empírico y posteriormente cambiarlo, si es necesario, según los resultados del cultivo con antibiograma, conducta avalada por la experiencia y de uso universal en el tratamiento de las infecciones en general. Del mismo modo, es importante conocer la evolución local de las resistencias bacterianas, lo cual difiere en los distintos medios en donde se realice. La gentamicina y la piperacilina no son de uso rutinario en hospital donde se realizó la presente investigación, por lo cual no formaron parte de los antibiogramas realizados en el estudio. Sin embargo, la experiencia apoya el uso de estos medicamentos en la actualidad.
Cai T, et al. (9), demostraron que el tratamiento de la bacteriuria asintomática se asocia con alta recurrencia de bacterias resistentes a los antibióticos y esta actitud es potencialmente dañina en mujeres con IVU recurrente. Del mismo modo, Olson RP, et al. (10) encontraron que de 168 estudiantes captados en su estudio, 138 presentaron urianálisis (UA) positivo y 94 de ellos desarrollaron más de 100,000 colonias/mL de E. coli. La resistencia a la ampicilina fue de 32,0%, TMP-SMX de 16,0%, ciprofloxacino de 4,0%, amoxicilina/clavulanato 3,0% y nitrofurantoína 1,0%. La sensibilidad del UA fue de 95,0% y el valor predictivo positivo (VPP) de 87,0%. La especificidad de 77,0% y el valor predictivo negativo (VPN) de 93,0%.
En mujeres sanas con síntomas de IVU, la TMP-SMX no debe ser utilizada universalmente como tratamiento empírico, mientras que el uso de ciprofloxacino, amoxicilina/clavulanato, y nitrofurantoína sí están indicados. Por otra parte, la nitrofurantoína tampoco es un fármaco usual en el hospital objeto de este estudio.
Chulain MN, et al., (11) refieren que el conocimiento de los patrones de resistencia antimicrobiana en E. coli, el patógeno predominante asociado con IVU, es importante como guía para seleccionar la terapia antimicrobiana empírica. Ellos detectaron tres aislamientos con el fenotipo de la β-lactamasa de amplio espectro. Por lo tanto, la ampicilina/amoxicilina no es adecuada para la terapia empírica de las IVU en la práctica general o en pacientes hospitalizados en esa región. Existe duda sobre el papel del TMP-SMX en la terapia empírica de la IVU pero la nitrofurantoína, el ácido nalidíxico y el ciprofloxacino son activos contra la gran mayoría de E. coli asociada con las IVU. En este estudio la nitrofurantoína y el ácido nalidíxico resultaron todavía de elección para este tipo de infecciones; sin embargo, el ciprofloxacino fue el antibiótico con mayor resistencia en nuestro medio debido al uso indiscriminado de este antibiótico.
Por su parte, Ahmed MN, et al. (12), se dedicaron a identificar los factores de riesgo de resistencia a antibióticos de la E. coli en niños con IVU en clínicas de urgencias y atención primaria. Estos autores encontraron que en comparación con las niñas, los varones tuvieron 2.29 veces mayor probabilidad de tener cepas aisladas de E. Coli resistentes a la ampicilina y 2 veces más probabilidades de tener aislamientos resistentes a TMP/SMX. Los pacientes con anomalías genitourinarias tuvieron 1.57 veces más probabilidades de ser resistentes a ampicilina y 1.86 veces más probabilidades a TMP/SMX. Concluyeron que se observaron tasas más altas de cepas de E coli resistentes a ampicilina y TMP/SMX en niños y niños con antecedentes de anomalía genitourinaria. La edad y la prescripción antibiótica reciente también son factores potenciales de riesgo para la resistencia. No se encontraron estudios en nuestro medio sobre la resistencia en la consulta privada ni en los servicios de urgencias para valorar las tasas de resistencia bacteriana en estos escenarios.
Toner L, et al., (13) nos recuerdan que los enterococos son una causa común de IVU y las cepas resistentes a la vancomicina son más difíciles de tratar. El propósito de este programa de vigilancia fue evaluar la prevalencia y determinar los factores de riesgo para la vancomicina en adultos entre los aislamientos urinarios de Enterococcus sp., y para detallar el perfil de susceptibilidad a los antibióticos que puede utilizarse para guiar el tratamiento. De estos cultivos, 542 (9,8%) eran resistentes a la vancomicina. No se observó ninguna tendencia longitudinal en la proporción de cepas resistentes a la vancomicina durante el curso del estudio. Se observó una resistencia emergente a la nitrofurantoína con velocidades que subían de 0 a 40,0%. La resistencia a la ampicilina fluctuó entre 50,0% y 90,0%. Se observó baja resistencia para linezolid y quinupristina/alfopristina.
Bader MS, et al. (14), refieren que las infecciones complicadas del tracto urinario (cIVU) son una causa importante de admisiones hospitalarias y se asocian con costes significativos de la atención sanitaria. Los pacientes que presenten una IVU sospechosa deben ser examinados para detectar la presencia de factores asociados, como anomalías anatómicas y funcionales del tracto genitourinario. En el establecimiento de cIVU, la etiología y susceptibilidad del organismo causal no es predecible; por lo tanto, cuando se sospecha la infección, los pacientes deben someterse a un análisis de orina además de cultivo y pruebas de sensibilidad. Aunque no se justifica en todos los casos de pielonefritis complicada, los hemocultivos son apropiados en algunos contextos clínicos. Con el aumento de la prevalencia de resistencia a los antimicrobianos, y la falta de ensayos clínicos bien diseñados, el tratamiento de cIVU puede ser un reto para los médicos. Aunque los organismos resistentes no siempre están implicados como el agente causante, todos los pacientes con cIVU deben ser evaluados para los factores de riesgo predisponentes.
La consideración de un agente antimicrobiano óptimo debe basarse en patrones de resistencia locales, factores específicos del paciente, incluido el sitio anatómico de la infección y la gravedad de la enfermedad, los principios farmacocinéticos y farmacodinámicos y el costo. La resistencia a los agentes antimicrobianos de primera línea, incluidos las fluoroquinolonas, se ha hecho cada vez más frecuente en E. Coli. Las fluoroquinolonas no deben utilizarse como una opción de primera línea para el tratamiento empírico de cIVU graves, especialmente cuando los pacientes presentan factores de riesgo para albergar un organismo resistente, como el uso previo o reciente de fluoroquinolonas. Las fluoroquinolonas, TMP-SMX y nitrofurantoína siguen siendo las opciones empíricas adecuadas para los cIVU menores. Sin embargo, el tratamiento empírico para los cUTI graves, en los que existen factores de riesgo para organismos resistentes, debe incluir antibióticos de amplio espectro tales como carbapenems o piperacilina-tazobactam.
Una vez identificados los organismos y las susceptibilidades, el tratamiento debe orientarse en consecuencia. La nitrofurantoína y la fosfomicina tienen una utilidad limitada en el establecimiento de cIVU y deben reservarse como opciones de tratamiento alternativas para los cIVU más bajos después de la confirmación del organismo causal. Los aminoglucósidos, tigeciclina y polimixinas pueden usarse para el tratamiento de cIVU graves cuando las opciones de primera línea se consideran inapropiadas o los pacientes fracasan en la terapia. La duración del tratamiento para los cIVU no ha sido bien establecida; sin embargo, las duraciones del tratamiento pueden variar de 1 a 4 semanas basadas en la situación clínica.
Bader MS, et al. (15), nos dicen que las infecciones urinarias causadas por bacterias Gram-negativas resistentes a los antibióticos son una preocupación creciente debido a las limitadas opciones terapéuticas. Las bacterias Gram-negativas, específicamente Enterobacteriaceae, son causas comunes tanto de las IVU adquiridas en la comunidad como las IVU adquiridas en el hospital. Estos organismos pueden adquirir genes que codifican múltiples mecanismos de resistencia a los antibióticos, incluyendo lactamasas de amplio espectro, AmpC-β-lactamasa y carbapenemasas.
La evaluación de la IVU sospechosa incluye la identificación de síntomas o signos característicos, análisis de orina, prueba de varilla o pruebas microscópicas y cultivo de orina si se indica. Las IVU se clasifican según la localización (tracto urinario superior versus tracto urinario inferior) y la gravedad (sin complicaciones frente a las complicadas). El aumento de las tasas de resistencia a los antibióticos requiere un uso juicioso de los antibióticos a través de la aplicación de principios de administración antimicrobiana. El conocimiento de los patógenos causales comunes de las IVU, incluidos los patrones de susceptibilidad locales, son esenciales para determinar la terapia empírica apropiada. Las terapias empíricas de primera línea recomendadas para la cistitis bacteriana aguda no complicada en mujeres no embarazadas adultas sanas es un curso de 5 días de nitrofurantoína o una dosis única de 3 g de fosfomicina trometamina. Las opciones de segunda línea incluyen fluoroquinolonas y β-lactamasas, tales como amoxicilina-clavulanato.
Las opciones de tratamiento actuales para las IVU debidas a los organismos productores de AmpC-β-lactamasa incluyen fosfomicina, nitrofurantoína, fluoroquinolonas, cefepima, piperacilina-tazobactam y carbapenem. Además, las opciones de tratamiento para las IVU debidas a Enterobacteriaceae productoras de β-lactamasas de amplio espectro incluyen nitrofurantoína, fosfomicina, fluoroquinolonas, cefoxitina, piperacilina-tazobactam, carbapenem, ceftazidima-avibactam, ceftolozano-tazobactam y aminoglucósidos.
Basado en la identificación y los resultados de la susceptibilidad, las alternativas a carbapenems se pueden utilizar para tratar IVU leves a moderadas causado por Enterobacteriaceae productoras de β-lactamasas de amplio espectro. Ceftazidima-avibactam, colistina, polimixina B, fosfomicina, aztreonam, aminoglucósidos y tigeciclina son opciones de tratamiento para las IVU causadas por Enterobacteriaceae resistente a carbapenem. Las opciones de tratamiento para las infecciones urinarias causadas por Pseudomonas spp. multirresistentes incluyen fluoroquinolonas, ceftazidima, cefepima, piperacilina-tazobactam, carbapenems, aminoglucósidos, colistina, ceftazidima-avibactam, y ceftolozano-tazobactam. El uso de fluoroquinolonas para el tratamiento empírico de las IVU debe ser restringido debido al aumento de las tasas de resistencia. Los aminoglucósidos, colistina y tigeciclina se consideran alternativas en el establecimiento de infecciones de Gram-negativos resistente a multifármacos en pacientes con opciones terapéuticas limitadas.
Deepak S, et al. (16), enfatizan que la presencia de bacterias en la orina se asocia con una infección asintomática y sintomática del tracto urinario (IVU). La bacteriuria es parte de la dinámica de colonización microbiana del tracto urinario y probablemente afecte la progresión y persistencia de la infección en algunos individuos. Recientes descubrimientos moleculares in vitro han dilucidado cómo algunos rasgos bacterianos clave pueden permitir a los organismos sobrevivir y crecer en la orina humana como medio de adaptación microbiana. Se han identificado varias características microbianas que confieren potencial bacteriúrico, incluyendo síntesis de novo de guanina, resistencia relativa a D-serina y el catabolismo de ácido málico. Características microbianas como éstas se están definiendo cada vez más mediante el uso de orina humana sintética (OHS) in vitro como un modelo para imitar el ambiente in vivo de las bacterias que se encuentran en la vejiga. Existe variaciones considerables en los sistemas modelo OHS que se han utilizado para estudiar la bacteriuria hasta la fecha, lo que influye en la utilidad de estos modelos.
En este estudio se discutieron los recientes avances en el potencial bacteriúrico con un enfoque en los mecanismos específicos subyacentes a los rasgos que promueven el crecimiento de bacterias en la orina. También revisaron la aplicación de OHS en estudios de investigación modelando IVU. Este estudio se vio limitado por lo corto del periodo de estudio y es recomendable realizar nuevos estudios sobre este tema en diferentes sectores de la población, en etapas de la vida diferente y comparar a pacientes hospitalizados con pacientes ambulatorios.
CONCLUSIONES
Las bacterias identificados con mayor frecuencia en los cultivos fueron Escherichia coli, Klebsiella spp., y Proteus mirabilis. La mayor resistencia bacteriana de E. coli fue para las cefalosporinas, ciprofloxacino y amoxicilina. Klebsiella spp. presentó resistencia para amoxicilina-ácido clavulánico, cefotaxima y Trimetroprima-sulfametoxazol.
En nuestro estudio los antibióticos que presentaron mayor falla a bacterias resistentes fueron: eritromicina, ciprofloxacino y cefotaxima, lo cual seguramente es debido a la amplia prescripción de estos fármacos.
Los fármacos tradicionales como nitrofurantoína, gentamicina, fosfomicina, piperacilina y amikacina siguen siendo efectivos como primera opción de tratamiento en las IVU.
Agradecimientos: al QFB Martín Torres Vera por las facilidades para la realización de este estudio.
REFERENCIAS
- Haber MH. Pisse prophecy: a brief history of urinalysis. Clin Lab Med. 1988 Sep; 8(3):415-30.
- Schmiemann G, Kniehl E, Gebhardt K, Matejczyk MM, Hummers-Pradier E. DtschArzteblInt. 2010; 107(46):824-5.
3. Malmartel A, Ghasarossian C. Epidemiology of urinary tract infections, bacterial species and resistances in primary care in France. Eur J Clin Microbiol Infect Dis. 2016; 35(3):447-51.
4. van der Meeren BT, Chhaganlal KD, Pfeiffer A, Gomez E, Ferro JJ, Hilbink M, et al. Extremely high prevalence of multi-resistance among uropathogens from hospitalized children in Beira, Mozambique. S Afr Med J. 2013; 103(6):382-6.
- Mbanga J, Dube S, Munyanduki H. Prevalence and drug resistance in bacteria of the urinary tract infections in Bulawayo province, Zimbabwe. East Afr J Public Health. 2010; 7(3):229-32.
6. Fagan M, Lindbæk M, Grude N, Reiso H, Romøren M, Skaare D. et al. Antibiotic resistance patterns of bacteria causing urinary tract infections in the elderly living in nursing homes versus the elderly living at home: an observational study. BMC Geriatrics. 2015; 15:98. p. 1-7.
7. Hines MC, Al-Salamah T, Heil EL, Mallemat H, Witting MD, Johnson JK, et al. Resistance Patterns of Escherichia coli in Women with Uncomplicated Urinary Tract Infection Do Not Correlate with Emergency Department Antibiogram. J Emerg Med. 2015; 49(6):998-1003.
8. Catal F, Bavbek N, Bayrak O, Karabel M, Karabel D, Odemis E, et al. Antimicrobial resistance patterns of urinary tract pathogens and rationale for empirical therapy in Turkish children for the years 2000-2006.Int Urol Nephrol. 2009 Dec; 41(4):953-7.
9. Cai T, Nesi G, Mazzoli S, Meacci F, Lanzafame P, Caciagli P, et al. Asymptomatic bacteriuria treatment is associated with a higher prevalence of antibiotic resistant strains in women with urinary tract infections. Clin Infect Dis. 2015; 61(11):1655-61.
10. Olson RP, Haith K. Antibiotic resistance in urinary tract infections in college students. J Am Coll Health. 2012; 60(6):471-4.
11. Chulain MN, Murray AM, Corbett-Feeney G, Cormican M. Antimicrobial resistance in E. coli associated with urinary tract infection in the west of Ireland. Ir J Med Sci. 2005; 174(4):6-9.
12. Ahmed MN, Vannoy D, Frederick A, Chang S, Lawler E. First-Line Antimicrobial Resistance Patterns of Escherichia coli in Children with Urinary Tract Infection in Emergency Department and Primary Care Clinics. Clin Pediatr (Phila). 2016; 55(1):19-28.
13. Chang UI, Kim HW, Wie SH. Use of cefuroxime for women with community-onset acute pyelonephritis caused by cefuroxime-susceptible or -resistant Escherichia coli. Korean J Intern Med. 2016; 31:145-155.
14. Toner L, Papa N, Aliyu SH, Dev H, Lawrentschuk N, Al-Hayek S. Vancomycin resistant enterococci in urine cultures: Antibiotic susceptibility trends over a decade at a tertiary hospital in the United Kingdom. IC Urology. 2016; 57:129-134.
15. Majumder MI, Ahmed T, Hossain D, Begum SA. Bacteriology and antibiotic sensitivity patterns of urinary tract infections in a tertiary hospital in Bangladesh. Mymensingh Med J. 2014; 23(1):99-104.
16. Bader MS, Hawboldt J, Brooks A. Management of complicated urinary tract infections in the era of antimicrobial resistance. Postgrad Med. 2010; 122(6):7-15.





